Hỗn hợp khí X gồm H2 và hai hidrocacbon A, B được chứa trong một bình kín có sẵn bột Ni, đun nóng bình đến khi phản ứng hoàn toàn thu được 13,44 lít khí Y ở đktc, chia Y thành 2 phần bằng nhau: - Phần 1: Dẫn qua dung dịch nước brom thấy dung dịch nhạt màu và thu được duy nhất một hidrocacbon A. Đốt cháy hoàn toàn A thu được CO2 và H2O với tỷ lệ về khối lượng tương ứng là 88:45 - Phần 2: đốt cháy hoàn toàn thu đựowc 30,8 gam CO2 và 10,8 gam H2O. Trả lời câu hỏi dưới đây:Tính thành phần % theo thể tích các khí trong X?

Câu hỏi
Nhận biếtHỗn hợp khí X gồm H2 và hai hidrocacbon A, B được chứa trong một bình kín có sẵn bột Ni, đun nóng bình đến khi phản ứng hoàn toàn thu được 13,44 lít khí Y ở đktc, chia Y thành 2 phần bằng nhau:
- Phần 1: Dẫn qua dung dịch nước brom thấy dung dịch nhạt màu và thu được duy nhất một hidrocacbon A. Đốt cháy hoàn toàn A thu được CO2 và H2O với tỷ lệ về khối lượng tương ứng là 88:45
- Phần 2: đốt cháy hoàn toàn thu đựowc 30,8 gam CO2 và 10,8 gam H2O.
Trả lời câu hỏi dưới đây:
Tính thành phần % theo thể tích các khí trong X?
Đáp án đúng: A
Lời giải của Luyện Tập 365
Gọi số mol CH4 = x; số mol C2H2 = y; số mol H2 = z trong ½ X
Theo bảo toàn nguyên tố ta có số nguyên tử H trong ½ X bằng trong H2O và số nguyên tử C trong ½ X bằng trong CO2 khi đốt cháy ½ Y.
Vậy số mol CO2 = 4x +2y = 0,7
n1/2Y = x + y = 0,3
nH = 10x + 2y + 2z = 1,2
=>x = 0,05; y = 0,25; z = 0,1
=>∑n1/2X = 0,4
=>X có:%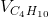 =
= 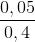 = 12,5%
= 12,5%
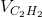 =
= 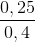 = 62,5%
= 62,5%
%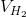 = 25%
= 25%
Gọi số mol CH4 = x; số mol C2H2 = y; số mol H2 = z trong ½ X
Theo bảo toàn nguyên tố ta có số nguyên tử H trong ½ X bằng trong H2O và số nguyên tử C trong ½ X bằng trong CO2 khi đốt cháy ½ Y.
Vậy số mol CO2 = 4x +2y = 0,7
n1/2Y = x + y = 0,3
nH = 10x + 2y + 2z = 1,2
=>x = 0,05; y = 0,25; z = 0,1
=>∑n1/2X = 0,4
=>X có:%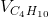 =
= 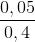 = 12,5%
= 12,5%
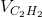 =
= 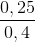 = 62,5%
= 62,5%
%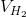 = 25%
= 25%
Câu hỏi liên quan
-

Cho m gam bột kim loại R có hóa trị không đổi vào 500ml dung dịch hỗn hợp gồm Cu(NO3)2 và AgNO3 đều có nồng độ 0,4M. Sau khi các phản ứng xảy ra hoàn toàn, thu được (m + 27,2) gam hỗn hợp rắn A và dung dịch Y. A tác dụng với dung dịch HCl có khí hydro thoát ra. Hãy xác định kim loại R và số mol muối tạo thành trong dung dịch Y
-

Lấy một thanh sắt nặng 16,8 gam cho vào 2 lít dung dịch hỗn hợp AgNO3 0,2M và Cu(NO3)2 0,1M. Thanh sắt có tan hết không? Tính nồng độ mol của chất tan có trong dung dịch thu được sau phản ứng. Biết các phản ứng xảy ra hoàn toàn và thể tích dung dịch thay đổi không đáng kể
-

Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn
Trả lời câu hỏi dưới đây:
-

Có một hỗn hợp M gồm MgCO3, FeCO3, MgO, FeO trong đó số mol mỗi muối cacbonat bằng số mol oxit kim loại tương ứng. Đem hòa tan hết hỗn hợp M trong dung dịch H2SO4 9,8% vừa đủ thì thu được dung dịch X. Tính nồng độ phần trăm của dung dịch FeSO4 có trong dung dịch X. Biết trong dung dịch X nồng độ phần trăm của dung dịch MgSO4 bằng 3,76%
-

Ba chất hữu cơ mạch hở A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2. Chúng có những tính chất sau:
- Chỉ A và B tác dụng với Na giải phóng khí H2
- Chỉ B và C tác dụng được với dung dịch NaOH
- A tác dụng với B (trong điều kiện xúc tác, nhiệt độ thích hợp) thu được sản phẩm là chất C.
Hãy cho biết công thức cấu tạo của A, B, C. Viết các phương trình phản ứng xảy ra
-

Cho từ từ dung dịch NaOH 2M vào dung dịch Y và khuấy đều đến khi thấy bắt đầu xuất hiện kết tủa thì dùng hết V1 lít dung dịch NaOH 2M, tiếp tục cho tiếp dung dịch NaOH vào đến khi lượng kết tủa không có sự thay đổi nữa thì lượng dung dịch NaOH 2M đã dùng hết 600ml. Tìm các giá trị m và V1
-

Cho sơ đồ chuyển hóa sau:
Hãy xác định các chất A, B, C, D, E, F, G, H. Viết các phương trình phản ứng hóa học xảy ra (ghi rõ điều kiện nếu có). Biết rằng:
- A, B, C, D là các hợp chất hữu cơ; E, F, G, H là các hợp chất vô cơ
- A tác dụng với dung dịch iot thấy xuất hiện màu xanh
- E tác dụng với H tạo ra F; F không tác dụng được với H
- G tác dụng được với dung dịch AgNO3 tạo kết tủa màu trắng
-

Đốt cháy hoàn toàn 11,5 gam hỗn hợp chất hữu cơ X chứa (C, H, O) rồi hấp thụ hết sản phẩm cháy vào bình đựng dung dịch nước vôi trong. Sau thí nghiệm thấy khối lượng bình tăng thêm 35,5 gam. Lọc, thu được 28 gam chất kết tủa và dung dịch Y, đun kỹ dung dịch Y thu thêm được 11 gam kết tủa nữa. Xác định công thức phân tử, công thức cấu tạo của X. Biết MX < 78 đvC
-

Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm C và H2, trong đó thể tích khí H2 thu được gấp đôi thể tích khí X (đo ở cùng điều kiện). Xác định các công thức phân tử thỏa mãn X
-

Cho 0,81 gam hỗn hợp A gồm 2 este đơn chức (phân tử chỉ chứa C, H, O) phản ứng vừa đủ với 5 gam dung dịch NaOH 8% thu được 1 muối và 2 rượu là đồng đẳng kế tiếp có số mol bằng nhau. Tìm công thức cấu tạo và tính khối lượng của mỗi este trong hỗn hợp A. Biết rằng một trong hai rượu thu được là rượu etylic
