A là dung dịch H2SO4 có nồng độ a (M). Trộn 500ml dung dịch A với 200 ml dung dịch KOH 2M, thu được dung dịch D. Biết ½ dung dịch D phản ứng vừa đủ với 0,39 gam Al(OH)3. Trả lời câu hỏi dưới đây:Tìm a.

Câu hỏi
Nhận biếtA là dung dịch H2SO4 có nồng độ a (M). Trộn 500ml dung dịch A với 200 ml dung dịch KOH 2M, thu được dung dịch D. Biết ½ dung dịch D phản ứng vừa đủ với 0,39 gam Al(OH)3.
Trả lời câu hỏi dưới đây:
Tìm a.
Đáp án đúng: C
Lời giải của Luyện Tập 365
Số mol các chất trong ½ dung dịch D:
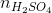 = ½. 0,5a = 0,25a mol
= ½. 0,5a = 0,25a mol
nKOH = ½ . 2. 0,2 = 0,2 mol
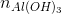 = 0,39 : 78 = 0,005 mol
= 0,39 : 78 = 0,005 mol
Dung dịch D phản ứng được với Al(OH)3 nên có 2 trường hợp : H2SO4 dư hoặc KOH dư.
TH1: Dung dịch D chứa H2SO4 dư
H2SO4 + 2KOH → K2SO4 + 2H2O (1)
0,1 ← 0,2 mol
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O (2)
 . 0,005← 0,005mol
. 0,005← 0,005mol
Suy ra:
Số mol H2SO4 là 0,1 + 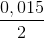
0,25a = 0,1075 mol
=> a = 0,43M
TH2: Dung dịch D chứa KOH dư:
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
0,25a → 0,5a mol
Al(OH)3 + KOH → KAlO2 + 2H2O (4)
0,005 → 0,005 mol
Suy ra:
nKOH = 0,5a + 0,005
=> (0.5a + 0,005) = 0,2
=> a = 0,39M
Số mol các chất trong ½ dung dịch D:
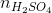 = ½. 0,5a = 0,25a mol
= ½. 0,5a = 0,25a mol
nKOH = ½ . 2. 0,2 = 0,2 mol
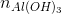 = 0,39 : 78 = 0,005 mol
= 0,39 : 78 = 0,005 mol
Dung dịch D phản ứng được với Al(OH)3 nên có 2 trường hợp : H2SO4 dư hoặc KOH dư.
TH1: Dung dịch D chứa H2SO4 dư
H2SO4 + 2KOH → K2SO4 + 2H2O (1)
0,1 ← 0,2 mol
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O (2)
 . 0,005← 0,005mol
. 0,005← 0,005mol
Suy ra:
Số mol H2SO4 là 0,1 + 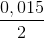
0,25a = 0,1075 mol
=> a = 0,43M
TH2: Dung dịch D chứa KOH dư:
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
0,25a → 0,5a mol
Al(OH)3 + KOH → KAlO2 + 2H2O (4)
0,005 → 0,005 mol
Suy ra:
nKOH = 0,5a + 0,005
=> (0.5a + 0,005) = 0,2
=> a = 0,39M
Câu hỏi liên quan
-

Có 6 ống nghiệm bị mất nhãn được đánh số theo thứ tự từ 1 đến 6. Mỗi ống nghiệm đựng một trong các dung dịch sau: BaCl2, H2SO4, Ca(OH)2, MgCl2, Na2CO3, KHSO4. Hãy xác định dung dịch có trong mỗi ống nghiệm, viết các phương trình phản ứng hóa học xảy ra. Biết rằng khi tiến hành thí nghiệm thu được kết quả như sau:
- Dung dịch ở ống 2 cho kết tủa với các dung dịch ở ống 3 và 4
- Dung dịch ở ống 6 cho kết tủa với các dung dịch ở ống 1 và 4
- Dung dịch ở ống 4 cho khi bay lên khi tác dụng với các dung dịch ở ống 3 và 5
-

Dẫn luồng khí CO dư qua hỗn hợp các chất: BaO, CuO, Fe3O4, Al2O3 nung nóng (các chất có số mol bằng nhau). Kết thúc các phản ứng thu được chất rắn X và khí Y. Cho X vào H2O (lấy dư) thu được dung dịch E và phần không tan Q. Cho Q vào dung dịch AgNO3 (số mol AgNO3 bằng hai lần tổng số mol các chất trong hỗn hợp ban đầu) thu được dung dịch T và chất rắn F. Lấy khí Y cho sục qua dung dịch T được dung dịch G và kết tủa H. Xác định thành phần các chất của X, Y, E, Q, F, T, G, H và viết các phương trình hóa học xảy ra
-

Metan bị lẫn một ít tạp chất là CO2, C2H4, C2H2. Trình bày phương pháp hóa học để loại hết tạp chất khỏi metan. Các hóa chất cần dùng là
-

Cho sơ đồ chuyển hóa sau:
Hãy xác định các chất A, B, C, D, E, F, G, H. Viết các phương trình phản ứng hóa học xảy ra (ghi rõ điều kiện nếu có). Biết rằng:
- A, B, C, D là các hợp chất hữu cơ; E, F, G, H là các hợp chất vô cơ
- A tác dụng với dung dịch iot thấy xuất hiện màu xanh
- E tác dụng với H tạo ra F; F không tác dụng được với H
- G tác dụng được với dung dịch AgNO3 tạo kết tủa màu trắng
-

Hòa tan hoàn toàn 0,297 gam hỗn hợp Natri và một kim loại thuộc nhóm IIA trong bảng tuần hoàn các nguyên tố hóa học vào nước. Ta được dung dịch X và 56ml khí Y (đktc). Xác định kim loại thuộc nhóm IIA và khối lượng của mỗi kim loại trong hỗn hợp
-

Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B
-

Một hỗn hợp gồm Al, Fe, Cu và Ag. Bằng phương pháp hóa học hãy tách rời hoàn toàn các kim loại ra khỏi hỗn hợp trên và cho biết các hóa chất cần sử dụng là gì?
-

Viết các phương trình phản ứng xảy ra và tìm giá trị của a
-

Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn
Trả lời câu hỏi dưới đây:
-

Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm C và H2, trong đó thể tích khí H2 thu được gấp đôi thể tích khí X (đo ở cùng điều kiện). Xác định các công thức phân tử thỏa mãn X
