Hòa tan hoàn toàn 5,94 gam bột Al vào dung dịch NaOH dư được khí A. Cho 1,896 gam KMNO4 tác dụng hết với axit HCl đặc dư, được khí B. Nhiệt phân hoàn toàn 12,25 gam KClO3 có xúc tác, thu được khí C. Cho toàn bộ lượng các khí điều chế ở trên vào một bình kín rồi đốt cháy để các phản ứng xảy ra hoàn toàn. Sau đó làm lạnh bình để cho hơi nước ngưng tụ hết và giả thiết các chất tan hết vào nước thu được dung dịch E. Viết các phương trình phản ứng và tính nồng độ C% của dung dịch E.

Câu hỏi
Nhận biếtHòa tan hoàn toàn 5,94 gam bột Al vào dung dịch NaOH dư được khí A. Cho 1,896 gam KMNO4 tác dụng hết với axit HCl đặc dư, được khí B. Nhiệt phân hoàn toàn 12,25 gam KClO3 có xúc tác, thu được khí C. Cho toàn bộ lượng các khí điều chế ở trên vào một bình kín rồi đốt cháy để các phản ứng xảy ra hoàn toàn. Sau đó làm lạnh bình để cho hơi nước ngưng tụ hết và giả thiết các chất tan hết vào nước thu được dung dịch E. Viết các phương trình phản ứng và tính nồng độ C% của dung dịch E.
Đáp án đúng: B
Lời giải của Luyện Tập 365
Số mol Al = 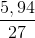 = 0,22 mol
= 0,22 mol
Số mol KMnO4 = 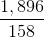 = 0,012 mol
= 0,012 mol
Số mol KClO3 = 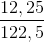 = 0,1 mol
= 0,1 mol
PTHH: 2H2O + 2Al + 2NaOH → 2NaAlO2 + 3H2 (1)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
2KClO3 → 2KCl + 3O2 (3)
Từ các PTHH ta có: 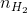 = 1,5. nAl = 1,5. 0,22 = 0,33 mol
= 1,5. nAl = 1,5. 0,22 = 0,33 mol
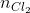 = 2,5.
= 2,5. 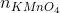 = 2,5. 0,012 = 0,03 mol
= 2,5. 0,012 = 0,03 mol
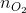 = 1,5 .
= 1,5 . 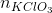 = 1,5. 0,1 = 0,15 mol
= 1,5. 0,1 = 0,15 mol
H2 + Cl2 → 2HCl (4)
2H2 + O2 → 2H2O (5)
Số mol H2 (4 +5) = 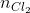 + 2.
+ 2. 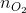 = 0,03 + 2. 0,15 = 0,33 mol =
= 0,03 + 2. 0,15 = 0,33 mol = 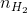 (1)
(1)
Vậy các khí phản ứng với nhau vừa đủ tạo ra sản phẩm là HCl và H2O:
nHCl = 2. 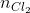 = 2. 0,03 = 0,06 mol;
= 2. 0,03 = 0,06 mol; 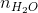 = 2.
= 2. 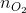 = 2. 0,15 = 0,3 mol
= 2. 0,15 = 0,3 mol
C%HCl = 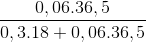 . 100% = 28,85%.
. 100% = 28,85%.
Số mol Al = 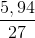 = 0,22 mol
= 0,22 mol
Số mol KMnO4 = 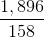 = 0,012 mol
= 0,012 mol
Số mol KClO3 = 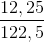 = 0,1 mol
= 0,1 mol
PTHH: 2H2O + 2Al + 2NaOH → 2NaAlO2 + 3H2 (1)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
2KClO3 → 2KCl + 3O2 (3)
Từ các PTHH ta có: 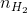 = 1,5. nAl = 1,5. 0,22 = 0,33 mol
= 1,5. nAl = 1,5. 0,22 = 0,33 mol
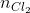 = 2,5.
= 2,5. 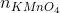 = 2,5. 0,012 = 0,03 mol
= 2,5. 0,012 = 0,03 mol
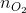 = 1,5 .
= 1,5 . 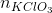 = 1,5. 0,1 = 0,15 mol
= 1,5. 0,1 = 0,15 mol
H2 + Cl2 → 2HCl (4)
2H2 + O2 → 2H2O (5)
Số mol H2 (4 +5) = 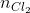 + 2.
+ 2. 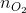 = 0,03 + 2. 0,15 = 0,33 mol =
= 0,03 + 2. 0,15 = 0,33 mol = 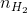 (1)
(1)
Vậy các khí phản ứng với nhau vừa đủ tạo ra sản phẩm là HCl và H2O:
nHCl = 2. 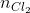 = 2. 0,03 = 0,06 mol;
= 2. 0,03 = 0,06 mol; 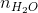 = 2.
= 2. 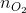 = 2. 0,15 = 0,3 mol
= 2. 0,15 = 0,3 mol
C%HCl = 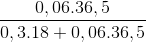 . 100% = 28,85%.
. 100% = 28,85%.
Câu hỏi liên quan
-

Đốt cháy hoàn toàn 11,5 gam hỗn hợp chất hữu cơ X chứa (C, H, O) rồi hấp thụ hết sản phẩm cháy vào bình đựng dung dịch nước vôi trong. Sau thí nghiệm thấy khối lượng bình tăng thêm 35,5 gam. Lọc, thu được 28 gam chất kết tủa và dung dịch Y, đun kỹ dung dịch Y thu thêm được 11 gam kết tủa nữa. Xác định công thức phân tử, công thức cấu tạo của X. Biết MX < 78 đvC
-

Viết các phương trình phản ứng xảy ra và tìm giá trị của a
-

Tính a
-

Hỗn hợp khí X gồm hai hiđrocacbon A và B (MA < MB) có thể tích bằng nhau. Đốt cháy hoàn toàn 1 lít X trong khí O2 thu được 1,5 lít khí CO2 và 1,5 lít hơi nước. Xác định công thức phân tử của các hiđrocacbon A và B. Biết rằng thể tích của các khí và hơi nước đo ở cùng điều kiện nhiệt độ và áp suất
-

Ba chất hữu cơ mạch hở A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2. Chúng có những tính chất sau:
- Chỉ A và B tác dụng với Na giải phóng khí H2
- Chỉ B và C tác dụng được với dung dịch NaOH
- A tác dụng với B (trong điều kiện xúc tác, nhiệt độ thích hợp) thu được sản phẩm là chất C.
Hãy cho biết công thức cấu tạo của A, B, C. Viết các phương trình phản ứng xảy ra
-

Cho lần lượt từng chất: Fe, BaO, Al2O3 và KOH vào lần lượt các dung dịch: NaHSO4, CuSO4. Có bao nhiêu phản ứng xảy ra? Hãy viết các phương trình phản ứng
-

Có 6 ống nghiệm bị mất nhãn được đánh số theo thứ tự từ 1 đến 6. Mỗi ống nghiệm đựng một trong các dung dịch sau: BaCl2, H2SO4, Ca(OH)2, MgCl2, Na2CO3, KHSO4. Hãy xác định dung dịch có trong mỗi ống nghiệm, viết các phương trình phản ứng hóa học xảy ra. Biết rằng khi tiến hành thí nghiệm thu được kết quả như sau:
- Dung dịch ở ống 2 cho kết tủa với các dung dịch ở ống 3 và 4
- Dung dịch ở ống 6 cho kết tủa với các dung dịch ở ống 1 và 4
- Dung dịch ở ống 4 cho khi bay lên khi tác dụng với các dung dịch ở ống 3 và 5
-

Cho hỗn hợp A gồm các chất (K2O, Ca(NO3)2, NH4NO3, KHCO3) có số mol bằng nhau vào nước (dư), sau khi các phản ứng xảy ra hoàn toàn, đun nóng đến khi không còn khí thoát ra, thu được dung dịch B. Xác định chất tan và môi trường của dung dịch B
-

Có 5 lọ mất nhãn đựng 5 dung dịch: NaOH, KCl, MgCl2, CuCl2, AlCl3. Hãy nhận biết từng dung dịch trên mà không dùng thêm hóa chất khác. Viết các phương trình phản ứng xảy ra và cho biết thứ tự nhận biết các dung dịch là
-

Trộn V1 lít dung dịch H2SO4 0,3M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A. Tính V1, V2. Biết rằng 0,6 lít dung dịch A hòa tan vừa đủ 0,54 gam Al và các phản ứng xảy ra hoàn toàn
