Hòa tan hoàn toàn 5,94 gam bột Al vào dung dịch NaOH dư được khí A. Cho 1,896 gam KMnO4 tác dụng hết với axit HCl đặc dư, được khí B. Nhiệt phân hoàn toàn 12,25 gam KClO3 có xúc tác, thu được khí C. Cho toàn bộ lượng các khí điều chế ở trên vào một bình kín rồi đốt cháy để các phản ứng xảy ra hoàn toàn. Sau đó làm lạnh bình để cho hơi nước ngưng tụ hết và giả thiết các chất tan hết vào nước thu được dung dịch E. Viết các phương trình hóa học và tính nồng độ C% của dung dịch E:

Câu hỏi
Nhận biếtHòa tan hoàn toàn 5,94 gam bột Al vào dung dịch NaOH dư được khí A. Cho 1,896 gam KMnO4 tác dụng hết với axit HCl đặc dư, được khí B. Nhiệt phân hoàn toàn 12,25 gam KClO3 có xúc tác, thu được khí C. Cho toàn bộ lượng các khí điều chế ở trên vào một bình kín rồi đốt cháy để các phản ứng xảy ra hoàn toàn. Sau đó làm lạnh bình để cho hơi nước ngưng tụ hết và giả thiết các chất tan hết vào nước thu được dung dịch E. Viết các phương trình hóa học và tính nồng độ C% của dung dịch E:
Đáp án đúng: B
Lời giải của Luyện Tập 365
Ta có phản ứng:
2Al + 2NaOH + 2H2O → 3H2 + 2NaAlO2 (1)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
2KClO3 → 2KCl + 3O2 (3)
Theo từng phương trình ta có: 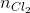 =
= 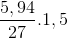 = 0,33 (mol)
= 0,33 (mol)
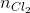 =
= 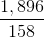 . 2,5 = 0,03 (mol)
. 2,5 = 0,03 (mol)
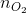 =
= 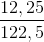 . 1,5 = 1,15 (mol)
. 1,5 = 1,15 (mol)
H2 + Cl2 → 2HCl (4)
2H2 + O2 → 2H2O (5)
Các khí phản ứng với nhau vừa đủ tạo ra lượng HCl = 0,06 (mol) và 0,3 (mol) H2O
C%HCl = 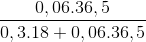 . 100% = 28,85%
. 100% = 28,85%
Ta có phản ứng:
2Al + 2NaOH + 2H2O → 3H2 + 2NaAlO2 (1)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
2KClO3 → 2KCl + 3O2 (3)
Theo từng phương trình ta có: 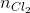 =
= 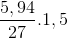 = 0,33 (mol)
= 0,33 (mol)
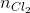 =
= 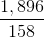 . 2,5 = 0,03 (mol)
. 2,5 = 0,03 (mol)
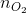 =
= 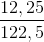 . 1,5 = 1,15 (mol)
. 1,5 = 1,15 (mol)
H2 + Cl2 → 2HCl (4)
2H2 + O2 → 2H2O (5)
Các khí phản ứng với nhau vừa đủ tạo ra lượng HCl = 0,06 (mol) và 0,3 (mol) H2O
C%HCl = 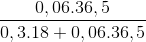 . 100% = 28,85%
. 100% = 28,85%
Câu hỏi liên quan
-

Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B
-

Ba chất hữu cơ mạch hở A, B, C có công thức phân tử tương ứng là: C3H6O, C3H4O2, C6H8O2. Chúng có những tính chất sau:
- Chỉ A và B tác dụng với Na giải phóng khí H2
- Chỉ B và C tác dụng được với dung dịch NaOH
- A tác dụng với B (trong điều kiện xúc tác, nhiệt độ thích hợp) thu được sản phẩm là chất C.
Hãy cho biết công thức cấu tạo của A, B, C. Viết các phương trình phản ứng xảy ra
-

Hòa tan hoàn toàn 0,297 gam hỗn hợp Natri và một kim loại thuộc nhóm IIA trong bảng tuần hoàn các nguyên tố hóa học vào nước. Ta được dung dịch X và 56ml khí Y (đktc). Xác định kim loại thuộc nhóm IIA và khối lượng của mỗi kim loại trong hỗn hợp
-

Tính a
-

Hiđrocacbon X là chất khí (ở nhiệt độ phòng, 250C). Nhiệt phân hoàn toàn X (trong điều kiện không có oxi) thu được sản phẩm C và H2, trong đó thể tích khí H2 thu được gấp đôi thể tích khí X (đo ở cùng điều kiện). Xác định các công thức phân tử thỏa mãn X
-

Có 6 ống nghiệm bị mất nhãn được đánh số theo thứ tự từ 1 đến 6. Mỗi ống nghiệm đựng một trong các dung dịch sau: BaCl2, H2SO4, Ca(OH)2, MgCl2, Na2CO3, KHSO4. Hãy xác định dung dịch có trong mỗi ống nghiệm, viết các phương trình phản ứng hóa học xảy ra. Biết rằng khi tiến hành thí nghiệm thu được kết quả như sau:
- Dung dịch ở ống 2 cho kết tủa với các dung dịch ở ống 3 và 4
- Dung dịch ở ống 6 cho kết tủa với các dung dịch ở ống 1 và 4
- Dung dịch ở ống 4 cho khi bay lên khi tác dụng với các dung dịch ở ống 3 và 5
-

Cho m gam Fe tác dụng hết với oxi thu được 44,8 gam hỗn hợp chất rắn A gồm 2 oxit (FeO, Fe2O3). Cho toàn bộ lượng hỗn hợp A trên tác dụng hết với dung dịch HNO3 (dư), thu được dung dịch B và 4,48 lít hỗn hợp khí C (đktc) gồm các sản phẩm khử là NO và NO2, tỉ khối của hỗn hợp C so với H2 là 1. Tính giá trị của m
-

Viết các phương trình phản ứng xảy ra và tìm giá trị của a
-

Có một hỗn hợp M gồm MgCO3, FeCO3, MgO, FeO trong đó số mol mỗi muối cacbonat bằng số mol oxit kim loại tương ứng. Đem hòa tan hết hỗn hợp M trong dung dịch H2SO4 9,8% vừa đủ thì thu được dung dịch X. Tính nồng độ phần trăm của dung dịch FeSO4 có trong dung dịch X. Biết trong dung dịch X nồng độ phần trăm của dung dịch MgSO4 bằng 3,76%
-

Trộn V1 lít dung dịch H2SO4 0,3M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A. Tính V1, V2. Biết rằng 0,6 lít dung dịch A hòa tan vừa đủ 0,54 gam Al và các phản ứng xảy ra hoàn toàn
