(2,25 điểm)
1. Chỉ được dùng thêm dung dịch axit HCl hãy nhận biết các chất rắn, màu trắng, đựng riêng biệt trong các lọ mất nhãn: NaCl, Na2CO3, BaCO3, BaSO4.
2. Hòa tan kim loại A bằng axit H2SO4 đặc, nóng theo phản ứng:
A + H2SO4 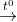 ASO4 + X + H2O ( X là SO2 hoặc H2S)
Biết khi hòa tan hoàn toàn 7,2 gam A thì thu được 1680 ml khí X (đktc). Hãy xác định khí X và kim loại A.
3. Nhiệt phân hoàn toàn hỗn hợp gồm KMnO4 và KClO3, sau phản ứng thu được 21,65 gam chất rắn A (trong A nguyên tố kali chiếm 36,03% về khối lượng) và khí B. Tính thể tích khí B ở điều kiện tiêu chuẩn?
ASO4 + X + H2O ( X là SO2 hoặc H2S)
Biết khi hòa tan hoàn toàn 7,2 gam A thì thu được 1680 ml khí X (đktc). Hãy xác định khí X và kim loại A.
3. Nhiệt phân hoàn toàn hỗn hợp gồm KMnO4 và KClO3, sau phản ứng thu được 21,65 gam chất rắn A (trong A nguyên tố kali chiếm 36,03% về khối lượng) và khí B. Tính thể tích khí B ở điều kiện tiêu chuẩn?

Câu hỏi
Nhận biết(2,25 điểm)
1. Chỉ được dùng thêm dung dịch axit HCl hãy nhận biết các chất rắn, màu trắng, đựng riêng biệt trong các lọ mất nhãn: NaCl, Na2CO3, BaCO3, BaSO4.
2. Hòa tan kim loại A bằng axit H2SO4 đặc, nóng theo phản ứng:
A + H2SO4 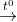 ASO4 + X + H2O ( X là SO2 hoặc H2S)
ASO4 + X + H2O ( X là SO2 hoặc H2S)
Biết khi hòa tan hoàn toàn 7,2 gam A thì thu được 1680 ml khí X (đktc). Hãy xác định khí X và kim loại A.
3. Nhiệt phân hoàn toàn hỗn hợp gồm KMnO4 và KClO3, sau phản ứng thu được 21,65 gam chất rắn A (trong A nguyên tố kali chiếm 36,03% về khối lượng) và khí B. Tính thể tích khí B ở điều kiện tiêu chuẩn?
Đáp án đúng:
Lời giải của Luyện Tập 365
1.
- Nhỏ dung dịch axit HCl đến dư vào mỗi bình :
+ Dung dịch trong suốt : NaCl
+ Sủi bọt khí :Na2CO3 ; BaCO3
Na2CO3 + 2HCl -> 2NaCl + CO2 + H2O
BaCO3 + 2HCl -> BaCl2 + CO2 + H2O
+ Có kết tủa trắng : BaSO4
- Xét nhóm 2 chất có sủi bọt khí. Cho lượng dư mỗi chất vào mỗi bình HCl có thể tích như nhau,Sau một thời gian bình nào xuất hiện kết tủa thì đó là BaCO3, còn lại là Na2CO3.
2.
, nX = 0,075 mol. Giả sử số oxi hóa của S trong X là a
Bảo toàn e : 2.nA = (6 – a).0,075
Mà nA = 7,2/MA
=> MA = 192/(6 – a)
+) Nếu a = 4 (X là SO2) thì MA = 96g (không có kim loại thỏa mãn)
+) Nếu a = - 2 (X là H2S) thì MA = 24g (Mg)
Vậy A là Mg ; X là H2S
3.
Phản ứng :
2KMnO4 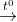 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2KClO3 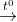 2KCl + 3O2
2KCl + 3O2
Có %mK = 36,03% => nK = 0,2 mol
Nếu gọi số mol KMnO4 và KClO3 lần lượt là x và y
=> x + y = 0,2 mol
Lại có : mA = mK2MnO4 + mMnO2 + mKCl = 142x + 37,25y = 21,65g
=> x = 0,1 ; y = 0,2 mol
=> nO2 = 0,5x + 1,5y = 0,35 mol
VO2 = 7,84 lit
1.
- Nhỏ dung dịch axit HCl đến dư vào mỗi bình :
+ Dung dịch trong suốt : NaCl
+ Sủi bọt khí :Na2CO3 ; BaCO3
Na2CO3 + 2HCl -> 2NaCl + CO2 + H2O
BaCO3 + 2HCl -> BaCl2 + CO2 + H2O
+ Có kết tủa trắng : BaSO4
- Xét nhóm 2 chất có sủi bọt khí. Cho lượng dư mỗi chất vào mỗi bình HCl có thể tích như nhau,Sau một thời gian bình nào xuất hiện kết tủa thì đó là BaCO3, còn lại là Na2CO3.
2.
, nX = 0,075 mol. Giả sử số oxi hóa của S trong X là a
Bảo toàn e : 2.nA = (6 – a).0,075
Mà nA = 7,2/MA
=> MA = 192/(6 – a)
+) Nếu a = 4 (X là SO2) thì MA = 96g (không có kim loại thỏa mãn)
+) Nếu a = - 2 (X là H2S) thì MA = 24g (Mg)
Vậy A là Mg ; X là H2S
3.
Phản ứng :
2KMnO4 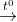 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2KClO3 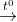 2KCl + 3O2
2KCl + 3O2
Có %mK = 36,03% => nK = 0,2 mol
Nếu gọi số mol KMnO4 và KClO3 lần lượt là x và y
=> x + y = 0,2 mol
Lại có : mA = mK2MnO4 + mMnO2 + mKCl = 142x + 37,25y = 21,65g
=> x = 0,1 ; y = 0,2 mol
=> nO2 = 0,5x + 1,5y = 0,35 mol
VO2 = 7,84 lit
Câu hỏi liên quan
-

Metan bị lẫn một ít tạp chất là CO2, C2H4, C2H2. Trình bày phương pháp hóa học để loại hết tạp chất khỏi metan. Các hóa chất cần dùng là
-

Lấy một thanh sắt nặng 16,8 gam cho vào 2 lít dung dịch hỗn hợp AgNO3 0,2M và Cu(NO3)2 0,1M. Thanh sắt có tan hết không? Tính nồng độ mol của chất tan có trong dung dịch thu được sau phản ứng. Biết các phản ứng xảy ra hoàn toàn và thể tích dung dịch thay đổi không đáng kể
-

Chỉ dùng thêm thuốc thử duy nhất là dung dịch KOH, thứ tự nhận biết các dung dịch và nêu phương pháp phân biệt các dung dịch sau: Na2CO3, MgSO4, CH3COOH, C2H5OH
-

Hỗn hợp khí X gồm hai hiđrocacbon A và B (MA < MB) có thể tích bằng nhau. Đốt cháy hoàn toàn 1 lít X trong khí O2 thu được 1,5 lít khí CO2 và 1,5 lít hơi nước. Xác định công thức phân tử của các hiđrocacbon A và B. Biết rằng thể tích của các khí và hơi nước đo ở cùng điều kiện nhiệt độ và áp suất
-

Cho hỗn hợp A gồm các chất (K2O, Ca(NO3)2, NH4NO3, KHCO3) có số mol bằng nhau vào nước (dư), sau khi các phản ứng xảy ra hoàn toàn, đun nóng đến khi không còn khí thoát ra, thu được dung dịch B. Xác định chất tan và môi trường của dung dịch B
-

Đốt cháy hoàn toàn 11,5 gam hỗn hợp chất hữu cơ X chứa (C, H, O) rồi hấp thụ hết sản phẩm cháy vào bình đựng dung dịch nước vôi trong. Sau thí nghiệm thấy khối lượng bình tăng thêm 35,5 gam. Lọc, thu được 28 gam chất kết tủa và dung dịch Y, đun kỹ dung dịch Y thu thêm được 11 gam kết tủa nữa. Xác định công thức phân tử, công thức cấu tạo của X. Biết MX < 78 đvC
-

Có một hỗn hợp M gồm MgCO3, FeCO3, MgO, FeO trong đó số mol mỗi muối cacbonat bằng số mol oxit kim loại tương ứng. Đem hòa tan hết hỗn hợp M trong dung dịch H2SO4 9,8% vừa đủ thì thu được dung dịch X. Tính nồng độ phần trăm của dung dịch FeSO4 có trong dung dịch X. Biết trong dung dịch X nồng độ phần trăm của dung dịch MgSO4 bằng 3,76%
-

Viết các phương trình phản ứng xảy ra và tìm giá trị của a
-

Cho từ từ dung dịch NaOH 2M vào dung dịch Y và khuấy đều đến khi thấy bắt đầu xuất hiện kết tủa thì dùng hết V1 lít dung dịch NaOH 2M, tiếp tục cho tiếp dung dịch NaOH vào đến khi lượng kết tủa không có sự thay đổi nữa thì lượng dung dịch NaOH 2M đã dùng hết 600ml. Tìm các giá trị m và V1
-

Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn
Trả lời câu hỏi dưới đây:
