Trộn 100 g dung dịch chứa một muối sunfat của kim loại kiềm nồng độ 13,2% với 100g dung dịch NaHCO3 4,2%. Sau khi phản ứng xong thu được dung dịch A có khối lượng m (dung dịch A) < 200g. Cho 100g dung dịch BaCl2 20,8% vào dung dịch A, khi phản ứng xong người ta thấy dung dịch vẫn còn dư muối sunfat. Nếu thêm tiếp vào đó 20g dung dịch BaCl2 20,8% nữa thì dung dịch lại dư BaCl2 và lúc này thu được dung dịch D. Trả lời câu hỏi dưới đây:Xác định công thức của muối sunfat kim loại kiềm ban đầu.

Câu hỏi
Nhận biếtTrộn 100 g dung dịch chứa một muối sunfat của kim loại kiềm nồng độ 13,2% với 100g dung dịch NaHCO3 4,2%. Sau khi phản ứng xong thu được dung dịch A có khối lượng m (dung dịch A) < 200g. Cho 100g dung dịch BaCl2 20,8% vào dung dịch A, khi phản ứng xong người ta thấy dung dịch vẫn còn dư muối sunfat. Nếu thêm tiếp vào đó 20g dung dịch BaCl2 20,8% nữa thì dung dịch lại dư BaCl2 và lúc này thu được dung dịch D.
Trả lời câu hỏi dưới đây:
Xác định công thức của muối sunfat kim loại kiềm ban đầu.
Đáp án đúng: D
Lời giải của Luyện Tập 365
Do trộn 100g với 100g mà lượng dung dịch thu được <200g thì muối sunfat kim loại kiềm là muối axit (hidrosunfat)
2MHSO4 + 2NaHCO3 → M2SO4 + Na2SO4 + 2CO2↑ + 2H2O
Sự thoát khí CO2 làm giảm khối lượng (số mol CO2 = 0,05)
Theo phương trình sự tạo kết tủa với BaCl2 là muối sunfat:
MNaSO4 + BaCl2 → BaSO4↓ + MCl + NaCl
Vậy nếu coi số mol MHSO4 là x, ta có: (M+97)x = 13,2
=>x = 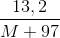
Với 0,1 < x < 0,12 thì 13<M<35 thỏa mãn Na = 23
Vậy công thức sunfat là NaHSO4 => x = 0,11
Khi phản ứng = 0,05 mol và còn dư = 0,06 mol trong dung dịch A.
Do trộn 100g với 100g mà lượng dung dịch thu được <200g thì muối sunfat kim loại kiềm là muối axit (hidrosunfat)
2MHSO4 + 2NaHCO3 → M2SO4 + Na2SO4 + 2CO2↑ + 2H2O
Sự thoát khí CO2 làm giảm khối lượng (số mol CO2 = 0,05)
Theo phương trình sự tạo kết tủa với BaCl2 là muối sunfat:
MNaSO4 + BaCl2 → BaSO4↓ + MCl + NaCl
Vậy nếu coi số mol MHSO4 là x, ta có: (M+97)x = 13,2
=>x = 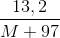
Với 0,1 < x < 0,12 thì 13<M<35 thỏa mãn Na = 23
Vậy công thức sunfat là NaHSO4 => x = 0,11
Khi phản ứng = 0,05 mol và còn dư = 0,06 mol trong dung dịch A.
Câu hỏi liên quan
-

Metan bị lẫn một ít tạp chất là CO2, C2H4, C2H2. Trình bày phương pháp hóa học để loại hết tạp chất khỏi metan. Các hóa chất cần dùng là
-

Tính a
-

Cho hỗn hợp A gồm các chất (K2O, Ca(NO3)2, NH4NO3, KHCO3) có số mol bằng nhau vào nước (dư), sau khi các phản ứng xảy ra hoàn toàn, đun nóng đến khi không còn khí thoát ra, thu được dung dịch B. Xác định chất tan và môi trường của dung dịch B
-

Có 6 ống nghiệm bị mất nhãn được đánh số theo thứ tự từ 1 đến 6. Mỗi ống nghiệm đựng một trong các dung dịch sau: BaCl2, H2SO4, Ca(OH)2, MgCl2, Na2CO3, KHSO4. Hãy xác định dung dịch có trong mỗi ống nghiệm, viết các phương trình phản ứng hóa học xảy ra. Biết rằng khi tiến hành thí nghiệm thu được kết quả như sau:
- Dung dịch ở ống 2 cho kết tủa với các dung dịch ở ống 3 và 4
- Dung dịch ở ống 6 cho kết tủa với các dung dịch ở ống 1 và 4
- Dung dịch ở ống 4 cho khi bay lên khi tác dụng với các dung dịch ở ống 3 và 5
-

Hòa tan Fe3O4 vào dung dịch H2SO4 (loãng, vừa đủ, không có không khí), thu được dung dịch A. Cho Cu (dư) vào dung dịch A, thu được dung dịch B. Thêm dung dịch NaOH (loãng, dư, không có không khí) vào dung dịch B, lọc lấy kết tủa đem nung trong không khí tới khối lượng không đổi. Có bao nhiêu phản ứng xảy ra? Viết các phương trình hóa học của các phản ứng đã xảy ra. Biết các phản ứng xảy ra hoàn toàn
-

Cho lần lượt từng chất: Fe, BaO, Al2O3 và KOH vào lần lượt các dung dịch: NaHSO4, CuSO4. Có bao nhiêu phản ứng xảy ra? Hãy viết các phương trình phản ứng
-

Có a gam hỗn hợp X gồm một axit no đơn chức A và một este B. B tạo ra bởi một axit no đơn chức A1 và một rượu no đơn chức C (A1 là đồng đẳng kế tiếp của A). Cho a gam hỗn hợp X tác dụng với lượng vừa đủ NaHCO3, thu được 1,92 gam muối. Nếu cho a gam hỗn hợp X tác dụng với một lượng vừa đủ NaOH đun nóng thu được 4,38 gam hỗn hợp hai muối của 2 axit A, A1 và 1,38 gam rượu C, tỷ khối hơi của C so với hiđro là 23. Đốt cháy hoàn toàn 4,38 gam hỗn hợp hai muối của A, A1 bằng một lượng oxi dư thì thu được Na2CO3, hơi nước và 2,128 lít CO2 (đktc). Giả thiết phản ứng xảy ra hoàn toàn
Trả lời câu hỏi dưới đây:
Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B
-

Cho 0,81 gam hỗn hợp A gồm 2 este đơn chức (phân tử chỉ chứa C, H, O) phản ứng vừa đủ với 5 gam dung dịch NaOH 8% thu được 1 muối và 2 rượu là đồng đẳng kế tiếp có số mol bằng nhau. Tìm công thức cấu tạo và tính khối lượng của mỗi este trong hỗn hợp A. Biết rằng một trong hai rượu thu được là rượu etylic
-

Có một hỗn hợp M gồm MgCO3, FeCO3, MgO, FeO trong đó số mol mỗi muối cacbonat bằng số mol oxit kim loại tương ứng. Đem hòa tan hết hỗn hợp M trong dung dịch H2SO4 9,8% vừa đủ thì thu được dung dịch X. Tính nồng độ phần trăm của dung dịch FeSO4 có trong dung dịch X. Biết trong dung dịch X nồng độ phần trăm của dung dịch MgSO4 bằng 3,76%
-

Từ metan và các chất vô cơ cần thiết cần ít nhất bao nhiêu phản ứng để điều chế Poli Vinyl Clorua; Poli Etilen. Hãy viết các phương trình hóa học ghi rõ điều kiện phản ứng (nếu có)
