Số electron tối đa trong lớp thứ ba là

Câu hỏi
Nhận biếtSố electron tối đa trong lớp thứ ba là
Đáp án đúng: C
Phương pháp giải
- Xác định các phân lớp của lớp
- Suy ra số e tối đa của lớp
- Xác định các phân lớp của lớp
- Suy ra số e tối đa của lớp
Lời giải của Luyện Tập 365
Lớp thứ 3 có các phân lớp là 3s; 3p và 3d
⟹ Số e tối đa của lớp 3 là 2 + 6 + 10 = 18
Lớp thứ 3 có các phân lớp là 3s; 3p và 3d
⟹ Số e tối đa của lớp 3 là 2 + 6 + 10 = 18
Câu hỏi liên quan
-

Cho các nguyên tố: Na (Z=11); O (Z=8) liên kết hoá học giữa Na và O thuộc loại:
-

Cho quá trình Mn+7 + 5e → Mn+2. Trong quá trình này:
-

Số e độc thân của nguyên tử lưu huỳnh (Z=16) bằng:
-

Một nguyên tố hoá học X ở chu kỳ 3, nhóm VA. Cấu hình e của nguyên tử X là:
-

Cân bằng các phản ứng oxi hóa- khử sau bằng phương pháp thăng bằng electron và cho biết chất oxi hóa, chất khử, sự oxi hóa, sự khử ở mỗi phản ứng:
a.Mg + H2SO4 → MgSO4 + S + H2O
b.NH3 + CuO → Cu + N2 + H2O
-

Trong tự nhiên Clo có hai đồng vị bền: 3717Clchiếm 25% tổng số nguyên tử, còn lại là 3517Cl. Tính thành phần % theo khối lượng của 3717Cl trong HClO3 ? ( lấy H=1, O= 16)
-

Số mol electron cần dùng để oxi hóa 2 mol Al thành 2 mol Al3+ là?
-

Phương trình hoá học nào sau đây là phản ứng oxi hóa khử?
-

R là nguyên tố nhóm A, công thức hợp chất khí của R với hiđro là RH3. Trong hợp chất oxit cao nhất của R, oxi chiếm 56,34% về khối lượng.
a.Xác định tên của R.
b.Viết công thức electron, công thức cấu tạo phân tử hợp chất của R với hiđro.
-

Cho cân bằng sau trong bình kín: 2NO2 (k)
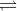 N2O4 (k) ở 250C
N2O4 (k) ở 250C (màu nâu đỏ) (không màu)
a) Viết công thức electron, công thức cấu tạo của NO2 và N2O4. Xác định cộng hoá trị và
số oxi hoá của N trong các hợp chất đó. Tại sao NO2 có thể đime hoá thành N2O4.
Cho N (Z=7); O(Z=8)
b) Khi giảm nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 tăng lên. Vậy khi hạ nhiệt
độ của bình thì màu nâu đỏ đậm lên hay nhạt đi? Phản ứng thuận toả nhiệt hay thu
nhiệt? Tại sao?
c) Khi tăng áp suất thì cân bằng trên chuyển dịch theo chiều nào? Tại sao?
d) Cho 18,4 gam N2O4 vào bình dung tích 5,904 lít ở 270C. Lúc cân bằng, áp suất của
hỗn hợp khí trong bình là 1 atm (nhiệt độ 270C).
