Phân lớp có mức năng lượng cao nhất trong các phân lớp sau là

Câu hỏi
Nhận biếtPhân lớp có mức năng lượng cao nhất trong các phân lớp sau là
Đáp án đúng: C
Phương pháp giải
Cách nhớ thứ tự các mức năng lượng từ thấp đến cao:
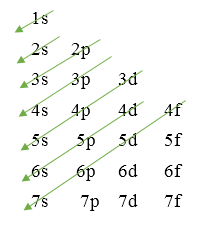
Cách nhớ thứ tự các mức năng lượng từ thấp đến cao:

Lời giải của Luyện Tập 365
Thứ tự mức năng lượng: 1s, 2s, 2p, 3s, 3p, 4s, 3d, ...
Vậy trong các phân lớp đề cho, phân lớp 3d có mức năng lượng cao nhất.
Thứ tự mức năng lượng: 1s, 2s, 2p, 3s, 3p, 4s, 3d, ...
Vậy trong các phân lớp đề cho, phân lớp 3d có mức năng lượng cao nhất.
Câu hỏi liên quan
-

a) Đồng vị phóng xạ 13153I được dùng trong nghiên cứu y học và chữa bệnh bướu cổ.
Một mẫu thử ban đầy có 1,00mg đồng vị đó. Sau 13,3 ngày lượng iot đó còn lại 0,32mg.
Tìm chu kì bán hủy của 13353I
b) Cân bằng phản ứng sau theo phương pháp thăng bằng electron và xác định vai trò của
các chất tham gia phản ứng.
Al + HNO3→Al(NO3)3 + N2O + H2O
c) Tính nồng độ mol của H+ và OH- trong dung dịch NaNO2 0,1M, biết rằng hằng số
điện li bazơ của NO2- là Kb = 2,5.10-11.
-

Ion X- có cấu hình electron là 1s22s22p6. Trong ion X- số hạt mang điện nhiều hơn số hạt không mang điện là 9. Viết kí hiệu nguyên tử của nguyên tố X.
-

Nguyên tố X thuộc chu kì 4 nhóm IA, nguyên tố Y thuộc chu kì 2 nhóm VIIA.
Viết cấu hình electron nguyên tử các nguyên tố X, Y. Viết sơ đồ hình thành liên kết trong phân tử tạo thành từ X và Y.
-

Cân bằng các phản ứng oxi hóa- khử sau bằng phương pháp thăng bằng electron và cho biết chất oxi hóa, chất khử, sự oxi hóa, sự khử ở mỗi phản ứng:
a.Mg + H2SO4 → MgSO4 + S + H2O
b.NH3 + CuO → Cu + N2 + H2O
-

Cho quá trình Mn+7 + 5e → Mn+2. Trong quá trình này:
-

Trong phản ứng 3NO2 + H2O → 2HNO3 + NO. NO2 đóng vai trò gì?
-

Cho 10,2 gam oxit của kim loại R thuộc nhóm IIIA tác dụng vừa đủ với 600 ml dung dịch HCl 1M (D = 1,12 g/ml), sau phản ứng thu được dung dịch X.
a.Xác định công thức phân tử của oxit đã cho.
b.Tính nồng độ phần trăm của chất tan trong dung dịch X.
-

Một nguyên tố hoá học X ở chu kỳ 3, nhóm VA. Cấu hình e của nguyên tử X là:
-

Phương trình hoá học nào sau đây là phản ứng oxi hóa khử?
-

Cho cấu hình của ion X3+ : 1s22s22p63s23p63d5 . Xác định :
- Vị trí (chu kỳ, nhóm) của X trong bảng tuần hoàn ?
