Oxi hóa chậm m gam Fe ngoài không khí thu được 12 gam hỗn hợp x gồm FeO, Fe3O4, Fe2O3 và Fe dư. Hòa tan X vừa đủ bởi 200ml dung dịch HNO3 thu được 2,24 lít khí NO ( chất khử duy nhất, đo ở đktc). Giá trị của m và nồng độ mol dung dịch HNO3 lần lượt là

Câu hỏi
Nhận biếtOxi hóa chậm m gam Fe ngoài không khí thu được 12 gam hỗn hợp x gồm FeO, Fe3O4, Fe2O3 và Fe dư. Hòa tan X vừa đủ bởi 200ml dung dịch HNO3 thu được 2,24 lít khí NO ( chất khử duy nhất, đo ở đktc). Giá trị của m và nồng độ mol dung dịch HNO3 lần lượt là
Đáp án đúng: D
Lời giải của Luyện Tập 365
Sơ đồ các biến đổi xảy ra theo bài toán:
Fe 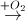 X
X 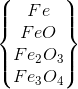
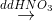 Khí NO(2,24 lít ,đktc)
Khí NO(2,24 lít ,đktc)
↓
Dung dịch Fe(NO3)3
m gam 12 gam
a)Tìm m:
cách 1: sử dụng phương pháp bảo toàn electron
‘-Các quá trình cho nhận electron:
Fe0 → Fe3+ + 3e O20 +4e → 2O2-2
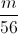 →
→ 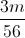
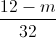 →
→ 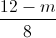
=> 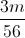 =
= 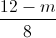 +0,3 => m = 10,08 (gam)
+0,3 => m = 10,08 (gam)
Cách 2: X { FeO, Fe3O4, Fe2O3 và Fe dư } ↔{ Fe: a(mol); O: b(mol)}
=> 56a + 16b = 12 (I)
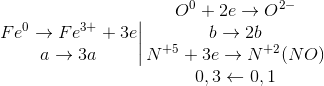
=> 3a = 2b + 0,3 (II)
Từ (I) và (II) => a = 0,18; b= 0,12 ; m = mFe= 56 x 0,18 = 10,08 ( gam)
b,Tìm nồng độ
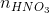 =
= 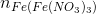 + nN(NO) = 3 x 0,18 + 0,1 = 0,64 (mol)
+ nN(NO) = 3 x 0,18 + 0,1 = 0,64 (mol)
=> [ HNO3] = 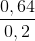 = 3,2 M.
= 3,2 M.
=>Đáp án D.
Sơ đồ các biến đổi xảy ra theo bài toán:
Fe 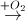 X
X 
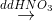 Khí NO(2,24 lít ,đktc)
Khí NO(2,24 lít ,đktc)
↓
Dung dịch Fe(NO3)3
m gam 12 gam
a)Tìm m:
cách 1: sử dụng phương pháp bảo toàn electron
‘-Các quá trình cho nhận electron:
Fe0 → Fe3+ + 3e O20 +4e → 2O2-2
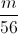 →
→ 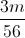
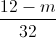 →
→ 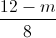
=> 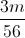 =
= 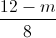 +0,3 => m = 10,08 (gam)
+0,3 => m = 10,08 (gam)
Cách 2: X { FeO, Fe3O4, Fe2O3 và Fe dư } ↔{ Fe: a(mol); O: b(mol)}
=> 56a + 16b = 12 (I)
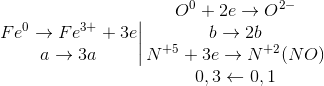
=> 3a = 2b + 0,3 (II)
Từ (I) và (II) => a = 0,18; b= 0,12 ; m = mFe= 56 x 0,18 = 10,08 ( gam)
b,Tìm nồng độ
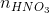 =
= 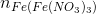 + nN(NO) = 3 x 0,18 + 0,1 = 0,64 (mol)
+ nN(NO) = 3 x 0,18 + 0,1 = 0,64 (mol)
=> [ HNO3] = 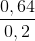 = 3,2 M.
= 3,2 M.
=>Đáp án D.
Câu hỏi liên quan
-

Cho hỗn hợp X gồm ancol metylic, etylen glicol và glixeron. Đốt cháy hoàn toàn m gam X thu được 6,72 lít khí CO2 (đktc). Cũng m gam X trên cho tác dụng với Na dư thu được tối đa V lít khí H2 (đktc). Giá trị của V là
-

Trong công nghiệp, amoniac được điều chế từ nitơ và hiđrô bằng phương pháp tổng hợp: N2 (k) + 3H2 (k) <=> 2NH3 (k). Phản ứng theo chiều thuận là phản ứng tỏa nhiệt. Về lý thuyết, cân bằng trên sẽ dịch chuyển về phía tạo thành amoniac nếu
-

Đốt cháy hoàn toàn 0,1 mol este X thu được 0,3 mol khí CO2 và 0,3 mol H2O. Nếu cho 0,1 mol X tác dụng hết với NaOH thì thu được 8,2 gam muối. X là
-

Cho các chất sau C6H5-NH2 (X); Cl-C6H4 -NH2 (Y); O2N-C6H4 -NH2 (Z); CH3-C6H4-NH2 (T). Chất có tính bazơ mạnh nhất là:
-

Hai chất được dùng để làm mềm nước cứng vĩnh cửu là:
-

Cho AgNO3 vào từng dung dịch NaF, NaCl, NaBr, NaI thì muối Halogen tạo được kết tủa là
-

Trong các chất HF, HCl, HBr và HI thì
-

Đốt cháy hoàn toàn 0,3 gam hợp chất X có tỉ khối hơi so với hiđro bằng 30, sản phẩm tạo ra chỉ gồm 224ml khí CO2 (đktc) và 0,18 gam H20. Chất X vừa phản ứng được với NaOH, vừa có phản ứng tráng gương. Vậy X là
-

Nhận định nào dưới đây là đúng?
-

Dung dịch NaHCO3 trong nước
