Nhiệt phân hoàn toàn hỗn hợp X gồm: Mg(NO3)2 và NaNO3, sau phản ứng thu được hỗn hợp khí Y. Dẫn hỗn hợp khí Y vào nước, thu được 1 lít dung dịch có pH = 1 và có 2,24 lít khí không màu thoát ra. Phần trăm khối lượng của NaNO3 trong hỗn hợp X là:

Câu hỏi
Nhận biếtNhiệt phân hoàn toàn hỗn hợp X gồm: Mg(NO3)2 và NaNO3, sau phản ứng thu được hỗn hợp khí Y. Dẫn hỗn hợp khí Y vào nước, thu được 1 lít dung dịch có pH = 1 và có 2,24 lít khí không màu thoát ra. Phần trăm khối lượng của NaNO3 trong hỗn hợp X là:
Đáp án đúng: A
Phương pháp giải
Tính toán theo PTHH:
Mg(NO3)2 \(\xrightarrow{{{t^o}}}\) MgO + 2NO2 + 0,5 O2
NaNO3 \(\xrightarrow{{{t^o}}}\) NaNO2 + 0,5O2
2NO2 + 0,5O2 + H2O → 2HNO3
Tính toán theo PTHH:
Mg(NO3)2 \(\xrightarrow{{{t^o}}}\) MgO + 2NO2 + 0,5 O2
NaNO3 \(\xrightarrow{{{t^o}}}\) NaNO2 + 0,5O2
2NO2 + 0,5O2 + H2O → 2HNO3
Lời giải của Luyện Tập 365
Đặt nMg(NO3)2 = x và nNaNO3 = y (mol)
PTHH: Mg(NO3)2 \(\xrightarrow{{{t^o}}}\) MgO + 2NO2 + 0,5 O2
x → x → 2x → 0,5x (mol)
NaNO3 \(\xrightarrow{{{t^o}}}\) NaNO2 + 0,5O2
y → y → 0,5y (mol)
Hỗn hợp khí Y gồm: NO2 (2x mol) và O2 (0,5x + 0,5y mol)
Dẫn Y vào H2O dư:
2NO2 + 0,5O2 + H2O → 2HNO3
2x → 0,5x dư 0,5y → 2x (mol)
Khí thoát ra là O2 dư => 0,5y = 0,1 => y = 0,2
Dung dịch thu được có pH = 1 => [H+] = 0,1M => nH+ = nHNO3 = 2x = 0,1 mol => x = 0,05 mol
=> %mNaNO3 = 0,2.85/(0,05.148 + 0,2.85) = 69,67%
Đặt nMg(NO3)2 = x và nNaNO3 = y (mol)
PTHH: Mg(NO3)2 \(\xrightarrow{{{t^o}}}\) MgO + 2NO2 + 0,5 O2
x → x → 2x → 0,5x (mol)
NaNO3 \(\xrightarrow{{{t^o}}}\) NaNO2 + 0,5O2
y → y → 0,5y (mol)
Hỗn hợp khí Y gồm: NO2 (2x mol) và O2 (0,5x + 0,5y mol)
Dẫn Y vào H2O dư:
2NO2 + 0,5O2 + H2O → 2HNO3
2x → 0,5x dư 0,5y → 2x (mol)
Khí thoát ra là O2 dư => 0,5y = 0,1 => y = 0,2
Dung dịch thu được có pH = 1 => [H+] = 0,1M => nH+ = nHNO3 = 2x = 0,1 mol => x = 0,05 mol
=> %mNaNO3 = 0,2.85/(0,05.148 + 0,2.85) = 69,67%
Câu hỏi liên quan
-

(1đ).
Hợp chất hữu cơ X (chứa C, H, O, N) có 46,67%N; 6,67%H về khối lượng. Đốt cháy hoàn toàn 3,6 gam X thu được 1,344 lít khí CO2 (đktc). Xác định công thức phân tử của X, biết X có công thức phân tử trùng với công thức đơn giản nhất.
-

(3 điểm)
1. Chọn chất phù hợp, viết phương trình (ghi rõ điều kiện phản ứng) thực hiện biến đổi sau về Nitơ và các hợp chất của nitơ :
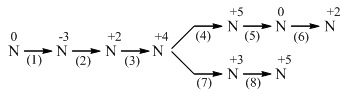
2. Hòa tan hoàn toàn 16,2 gam bột kim loại M hóa trị III vào 5 lít dung dịch HNO3 0,5M (d = 1,25g/ml). Sau khi phản ứng kết thúc thu được 2,8 lít (ở 0oC và 2 atm) hỗn hợp khí gồm NO, N2 . Trộn hỗn hợp khí này với lượng oxi vừa đủ thành hỗn hợp A, sau phản ứng thấy thể tích khí chỉ bằng 5/6 thể tích của hỗn hợp A.
Xác định nguyên tử khối và gọi tên kim loại M. Tính nồng độ % dung dịch HNO3 sau phản ứng.
-

(1đ)
Nhiệt phân hoàn toàn hỗn hợp X gồm KNO3 và Cu(NO3)2 thu được hỗn hợp khí Y có tỉ khối so với oxi là 1,25. Tính % khối lượng của KNO3 trong hỗn hợp X?
-

(4 điểm): Hoàn thành phương trình phân tử, viết phương trình ion thu gọn:
a. KOH + HCl
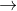
b. Ba(NO3)2 + Na2SO4
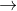
c. CuO + HNO3
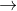
d. (NH4)2CO3 + NaOH
-

(1đ)
Nhiệt phân hoàn toàn hỗn hợp X gồm KNO3 và Cu(NO3)2 thu được hỗn hợp khí Y có tỉ khối so với oxi là d.
Tìm khoảng giá trị của d. Khi d = 1,3 thì % khối lượng của KNO3 trong hỗn hợp X là bao nhiêu?
-

(1,5đ)
Khi hoà tan 10,8 gam nhôm vào dung dịch HNO3 loãng vừa đủ thì thu được 2,912 lít (đktc) hỗn hợp X (gồm NO, N2O) và dung dịch Y. Trong dung dịch Y có 91,8 gam muối.
Viết các phương trình hoá học và tính thể tích mỗi khí có trong X.
-

(1đ).
Viết công thức cấu tạo đầy đủ và công thức cấu tạo thu gọn, thu gọn nhất của các chất: propilen (C3H6); etanal (CH3CHO).
-

(3 điểm):
a. Cho 16 gam Fe2O3 tác dụng vừa đủ với V ml dung dịch HNO3 1,5M, thu được dung dịch chứa a gam muối. Viết phương trình phản ứng xảy ra, tìm các giá trị V và a.
b. Hòa tan hoàn toàn 4,86 gam kim loại Al vào dung dịch HNO3 loãng, dư, thấy thoát ra 2,24 lít khí NO (ở đktc và là khí thoát ra duy nhất), tính khối lượng muối tan có trong dung dịch sau phản ứng.
-

(3 điểm)
1. X là một hiđrocacbon. Hiđro hóa hoàn toàn X thì thu đuợc 3-etylhexan. Tỉ khối hơi của X so với Hiđro bằng 52. Nếu cho 10,4 gam X tác dụng hoàn toàn với lượng dư dung dịch bạc nitrat trong amoniac thì tạo được 31,8 gam một chất rắn có màu vàng nhạt. Lập công thức phân tử và viết các công thức cấu tạo có thể có của X.
2. Y là hỗn hợp gồm hidrocacbon CxHy (A) và H2. Sau khi đun nóng hỗn hợp Y với xúc tác Ni ta chỉ thu được một khí K duy nhất. Ở cùng điều kiện nhiệt độ và áp suất, tỷ khối của K so với H2 gấp ba lần tỷ khối hơi của Y so với H2. Mặt khác nếu đốt cháy hoàn toàn một lượng khác của K thu được 22 gam CO2 và 13,5 gam nước. Xác định công thức phân tử của A.
-

(1,5đ)
Khi hoà tan 18 gam hỗn hợp X gồm Al và Mg vào dung dịch HNO3 loãng vừa đủ thì thu được 2,24 lít (đktc) khí N2O và dung dịch Y. Cho dung dịch NaOH dư vào dung dịch Y đun nhẹ thấy có 2,8 lít khí NH3 (đktc) thoát ra.
Viết các phương trình hoá học và tính số gam mỗi kim loại có trong X.
