Hòa tan hoàn toàn 14,2 gam một hỗn hợp C gồm MgCO3 và muối cacbonat của kim loại R vào axit HCl 7,3% vừa đủ, thu được dung dịch D và 3,36 lít khí CO2 (đktc). Nồng độ MgCl2 trong dung dịch D bằng 6,028%. Trả lời câu hỏi dưới đây:Xác định kim loại R?

Câu hỏi
Nhận biếtHòa tan hoàn toàn 14,2 gam một hỗn hợp C gồm MgCO3 và muối cacbonat của kim loại R vào axit HCl 7,3% vừa đủ, thu được dung dịch D và 3,36 lít khí CO2 (đktc). Nồng độ MgCl2 trong dung dịch D bằng 6,028%.
Trả lời câu hỏi dưới đây:
Xác định kim loại R?
Đáp án đúng: C
Lời giải của Luyện Tập 365
Số mol CO2 = 3,36:22,4= 0,15 mol
Các phản ứng xảy ra:
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑ (1)
R2(CO3)n + 2nHCl → 2RCln + nCO2 + nH2O (2)
Theo bài ra và các phản ứng ta có số mol HCl:
nHCl = 2. … = 2.0,15 = 0,3 mol
khối lượng dung dịch HCl 7,3% cần phản ứng:
mdd HCl 7,3% = 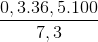 = 150 gam
= 150 gam
khối lượng dung dịch B thu được là:
mB = m + mdd HCl - 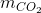 = 14,2 +150 – 0,15.44 = 157,6 gam
= 14,2 +150 – 0,15.44 = 157,6 gam
số mol CO2 ở phản ứng (1) là:
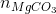 =
= 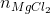 =
= 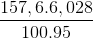 = 0,1 mol
= 0,1 mol
Do đó khối lượng MgCO3 là: 0,1x84= 8,4 gam
Số mol CO2ở phản ứng (2) là: 0,15 – 0,1 =0,05 mol
Do đó số mol R2(CO3)n là: 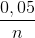 mol
mol
=>Khối lượng R2(CO3)n = 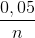 (2R+60)= 14,2 – 8,4 = 5,8 gam => R = 28n
(2R+60)= 14,2 – 8,4 = 5,8 gam => R = 28n
Chỉ có nghiệm n =2 và R = 56 (Fe) là thích hợp.
Số mol CO2 = 3,36:22,4= 0,15 mol
Các phản ứng xảy ra:
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑ (1)
R2(CO3)n + 2nHCl → 2RCln + nCO2 + nH2O (2)
Theo bài ra và các phản ứng ta có số mol HCl:
nHCl = 2. … = 2.0,15 = 0,3 mol
khối lượng dung dịch HCl 7,3% cần phản ứng:
mdd HCl 7,3% = 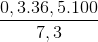 = 150 gam
= 150 gam
khối lượng dung dịch B thu được là:
mB = m + mdd HCl - 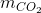 = 14,2 +150 – 0,15.44 = 157,6 gam
= 14,2 +150 – 0,15.44 = 157,6 gam
số mol CO2 ở phản ứng (1) là:
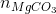 =
= 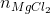 =
= 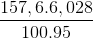 = 0,1 mol
= 0,1 mol
Do đó khối lượng MgCO3 là: 0,1x84= 8,4 gam
Số mol CO2ở phản ứng (2) là: 0,15 – 0,1 =0,05 mol
Do đó số mol R2(CO3)n là: 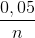 mol
mol
=>Khối lượng R2(CO3)n = 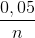 (2R+60)= 14,2 – 8,4 = 5,8 gam => R = 28n
(2R+60)= 14,2 – 8,4 = 5,8 gam => R = 28n
Chỉ có nghiệm n =2 và R = 56 (Fe) là thích hợp.
Câu hỏi liên quan
-

Hòa tan Fe3O4 vào dung dịch H2SO4 (loãng, vừa đủ, không có không khí), thu được dung dịch A. Cho Cu (dư) vào dung dịch A, thu được dung dịch B. Thêm dung dịch NaOH (loãng, dư, không có không khí) vào dung dịch B, lọc lấy kết tủa đem nung trong không khí tới khối lượng không đổi. Có bao nhiêu phản ứng xảy ra? Viết các phương trình hóa học của các phản ứng đã xảy ra. Biết các phản ứng xảy ra hoàn toàn
-

Trộn V1 lít dung dịch H2SO4 0,3M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A. Tính V1, V2. Biết rằng 0,6 lít dung dịch A hòa tan vừa đủ 0,54 gam Al và các phản ứng xảy ra hoàn toàn
-

Có a gam hỗn hợp X gồm một axit no đơn chức A và một este B. B tạo ra bởi một axit no đơn chức A1 và một rượu no đơn chức C (A1 là đồng đẳng kế tiếp của A). Cho a gam hỗn hợp X tác dụng với lượng vừa đủ NaHCO3, thu được 1,92 gam muối. Nếu cho a gam hỗn hợp X tác dụng với một lượng vừa đủ NaOH đun nóng thu được 4,38 gam hỗn hợp hai muối của 2 axit A, A1 và 1,38 gam rượu C, tỷ khối hơi của C so với hiđro là 23. Đốt cháy hoàn toàn 4,38 gam hỗn hợp hai muối của A, A1 bằng một lượng oxi dư thì thu được Na2CO3, hơi nước và 2,128 lít CO2 (đktc). Giả thiết phản ứng xảy ra hoàn toàn
Trả lời câu hỏi dưới đây:
Tìm công thức phân tử, công thức cấu tạo của A, A1, C, B
-

Đốt cháy hoàn toàn 11,5 gam hỗn hợp chất hữu cơ X chứa (C, H, O) rồi hấp thụ hết sản phẩm cháy vào bình đựng dung dịch nước vôi trong. Sau thí nghiệm thấy khối lượng bình tăng thêm 35,5 gam. Lọc, thu được 28 gam chất kết tủa và dung dịch Y, đun kỹ dung dịch Y thu thêm được 11 gam kết tủa nữa. Xác định công thức phân tử, công thức cấu tạo của X. Biết MX < 78 đvC
-

Hỗn hợp X gồm ba kim loại Al, Fe, Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn
Trả lời câu hỏi dưới đây:
-

Cho lần lượt từng chất: Fe, BaO, Al2O3 và KOH vào lần lượt các dung dịch: NaHSO4, CuSO4. Có bao nhiêu phản ứng xảy ra? Hãy viết các phương trình phản ứng
-

Cho hỗn hợp A gồm các chất (K2O, Ca(NO3)2, NH4NO3, KHCO3) có số mol bằng nhau vào nước (dư), sau khi các phản ứng xảy ra hoàn toàn, đun nóng đến khi không còn khí thoát ra, thu được dung dịch B. Xác định chất tan và môi trường của dung dịch B
-

Từ tinh bột, các hóa chất vô cơ và điều kiện cần thiết khác có đủ. Qua bao nhiêu phản ứng để điều chế được Etyl axetat? Viết phương trình hóa học (ghi rõ điều kiện nếu có)
-

Từ metan và các chất vô cơ cần thiết cần ít nhất bao nhiêu phản ứng để điều chế Poli Vinyl Clorua; Poli Etilen. Hãy viết các phương trình hóa học ghi rõ điều kiện phản ứng (nếu có)
-

Chỉ dùng thêm thuốc thử duy nhất là dung dịch KOH, thứ tự nhận biết các dung dịch và nêu phương pháp phân biệt các dung dịch sau: Na2CO3, MgSO4, CH3COOH, C2H5OH
