Cho 18,96g kim loại X có hóa trị II phản ứng vừa đủ với dung dịch axit nitric loãng. Phản ứng xảy ra hoàn toàn thu được 3,36 lit (đkc) một khí không màu nhẹ hơn không khí và dung dịch Y chứa 117,72g muối tan. Vậy kim loại X là :

Câu hỏi
Nhận biếtCho 18,96g kim loại X có hóa trị II phản ứng vừa đủ với dung dịch axit nitric loãng. Phản ứng xảy ra hoàn toàn thu được 3,36 lit (đkc) một khí không màu nhẹ hơn không khí và dung dịch Y chứa 117,72g muối tan. Vậy kim loại X là :
Đáp án đúng: C
Lời giải của Luyện Tập 365
Khí không màu nhẹ hơn không khí là N2, nN2 = 0,15 mol
Ta có: X + HNO3 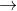 X(NO3)2 + N2 + NH4NO3 (có thể có)
X(NO3)2 + N2 + NH4NO3 (có thể có)
Gọi số mol X là x => n e cho = 2x mol
Bảo toàn e: 2x = 10nN2 + 8nNH4+
=> nNH4+ = 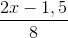
Muối gồm X(NO3)2 và NH4NO3
Bảo toàn điện tích: nNO3- (trong X(NO3)2) = n e cho = 2x mol
=> 18,96 + 2x.62 + 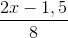 .80 = 117,72
.80 = 117,72
=> x = 0,79 mol
=> X = 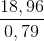 = 24 (Mg)
= 24 (Mg)
=> Đáp án C
Khí không màu nhẹ hơn không khí là N2, nN2 = 0,15 mol
Ta có: X + HNO3 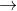 X(NO3)2 + N2 + NH4NO3 (có thể có)
X(NO3)2 + N2 + NH4NO3 (có thể có)
Gọi số mol X là x => n e cho = 2x mol
Bảo toàn e: 2x = 10nN2 + 8nNH4+
=> nNH4+ = 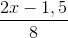
Muối gồm X(NO3)2 và NH4NO3
Bảo toàn điện tích: nNO3- (trong X(NO3)2) = n e cho = 2x mol
=> 18,96 + 2x.62 + 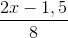 .80 = 117,72
.80 = 117,72
=> x = 0,79 mol
=> X = 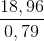 = 24 (Mg)
= 24 (Mg)
=> Đáp án C
Câu hỏi liên quan
-

Nung nóng một hỗn hợp gồm CaCO3 và MgO tới khối lượng không đổi, thì số gam chất rắn còn lại chỉ bằng
 số gam hỗn hợp trước khi nung. Vậy % theo khối lượng của CaCO3 trong hỗn hợp ban đầu là
số gam hỗn hợp trước khi nung. Vậy % theo khối lượng của CaCO3 trong hỗn hợp ban đầu là -

Cho các chất sau C6H5-NH2 (X); Cl-C6H4 -NH2 (Y); O2N-C6H4 -NH2 (Z); CH3-C6H4-NH2 (T). Chất có tính bazơ mạnh nhất là:
-

Dung dịch NaHCO3 trong nước
-

Hai chất được dùng để làm mềm nước cứng vĩnh cửu là:
-

Nhận định nào dưới đây là đúng?
-

Công thức hóa học của clorua vôi là
-

Trong các chất HF, HCl, HBr và HI thì
-

Hòa tan hết 7,2 gam hỗn hợp X gồm hai muối cacbonat của hai kim loại kế tiếp nhau trong nhóm IIA bằng dung dịch H2SO4 loãng, thu được khí Y. Cho toàn bộ khí Y hấp thụ hết bởi dung dịch Ba(OH)2 dư thu được 15,76 gam kết tủa. Hai kim loại ban đầu là
-

Chia m gam hỗn hợp gồm Na2O và Al2O3 thành 2 phần đều nhau: - Phần 1: Hòa tan trong nước dư thu được 1,02 gam chất rắn không tan - Phần 2: Hòa tan hết trong dung dịch HCl 1M thì cần vừa đủ 140ml dung dịch HCl. Khối lượng hỗn hợp ban đầu m có giá trị bằng
-

Hòa tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al4C3 vào dung dịch KOH (dư), thu được a mol hỗn hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Giá trị của a là
