Cho 11,04g hỗn hợp X gồm FeO ; Fe2O3 ; S ; FeS2 ; CuS trong đó O chiếm 14,5% về khối lượng. Cho X tác dụng vừa đủ với H2SO4 đặc nóng sinh ra 0,31 mol SO2 và dung dịch Y. Nhúng thanh Mg dư vào Y sau khí các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại tăng 2,8g ( giả sử 100% kim loại tạo ra bám hết vào thanh Mg).Đốt hoàn toàn m g X bằng lượng vừa đủ V(lit) (dktc) hỗn hợp A gồm O2 và O3 có tỉ khối so với H2 là 20. Giá trị của V là:

Câu hỏi
Nhận biếtCho 11,04g hỗn hợp X gồm FeO ; Fe2O3 ; S ; FeS2 ; CuS trong đó O chiếm 14,5% về khối lượng. Cho X tác dụng vừa đủ với H2SO4 đặc nóng sinh ra 0,31 mol SO2 và dung dịch Y. Nhúng thanh Mg dư vào Y sau khí các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại tăng 2,8g ( giả sử 100% kim loại tạo ra bám hết vào thanh Mg).Đốt hoàn toàn m g X bằng lượng vừa đủ V(lit) (dktc) hỗn hợp A gồm O2 và O3 có tỉ khối so với H2 là 20. Giá trị của V là:
Đáp án đúng: B
Lời giải của Luyện Tập 365
Qui hỗn hợp về : x mol Fe ; y mol Cu ; z mol S ; Oxi
Có %mO = 14,5% => nO = 0,1 mol
=> mX = 56x + 64y + 32z = 11,04g - 0,1.16 (1)
Khi phản ứng với H2SO4 xảy ra các quá trình:
+/ Cho e : Fe 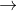 Fe+3 + 3e
Fe+3 + 3e
Cu 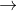 Cu+2 + 2e
Cu+2 + 2e
S 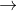 S+4 + 4e
S+4 + 4e
+/ Nhận e : S+6 + 2e 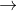 S+4
S+4
O +2e 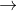 O-2
O-2
=> Bảo toàn e : 3x + 2y + 4z = 2nSO4 phản ứng + 2.0,1
=> nSO2 = nS + nSO4 phản ứng = 1,5x +y+ 3z – 0,1 = 0,31 (2)
Khi nhúng thanh Mg dư vào thì :
Ta có : Bảo toàn e => 2nMg = 3nFe + 2nCu = 3x +2y
=> mTăng = mFe + Cu – mMg phản ứng
=> 2,8 = 56x + 64y – 24.( 1,5x + y) (3)
Từ (1); (2) ; (3) => x = 0,1 mol ; y = 0,02 mol ; z = 0,08 mol
Khi đốt cháy : tạo Fe2O3 ; CuO ; SO2
=> Bảo toàn oxi ta có : moxi trong X + mOxi (A) = mOxi trong sản phẩm
=> nO(A) = 1,5.0,1 + 0,02 + 2.0,08 – 0,1 = 0,23 mol
Đặt nO2 và nO3 lần lượt là x và y mol
=> Bảo toàn O => 2x + 3y = 0,23 (1)
Lại có mA = 32x + 48y = 20.dA/H2.(x+ y) = 40(x+y) (2)
Từ (1) và (2) => x = y = 0,046 mol
=>V = 2,0608 l
=>B
Qui hỗn hợp về : x mol Fe ; y mol Cu ; z mol S ; Oxi
Có %mO = 14,5% => nO = 0,1 mol
=> mX = 56x + 64y + 32z = 11,04g - 0,1.16 (1)
Khi phản ứng với H2SO4 xảy ra các quá trình:
+/ Cho e : Fe 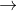 Fe+3 + 3e
Fe+3 + 3e
Cu 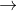 Cu+2 + 2e
Cu+2 + 2e
S 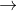 S+4 + 4e
S+4 + 4e
+/ Nhận e : S+6 + 2e 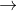 S+4
S+4
O +2e 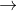 O-2
O-2
=> Bảo toàn e : 3x + 2y + 4z = 2nSO4 phản ứng + 2.0,1
=> nSO2 = nS + nSO4 phản ứng = 1,5x +y+ 3z – 0,1 = 0,31 (2)
Khi nhúng thanh Mg dư vào thì :
Ta có : Bảo toàn e => 2nMg = 3nFe + 2nCu = 3x +2y
=> mTăng = mFe + Cu – mMg phản ứng
=> 2,8 = 56x + 64y – 24.( 1,5x + y) (3)
Từ (1); (2) ; (3) => x = 0,1 mol ; y = 0,02 mol ; z = 0,08 mol
Khi đốt cháy : tạo Fe2O3 ; CuO ; SO2
=> Bảo toàn oxi ta có : moxi trong X + mOxi (A) = mOxi trong sản phẩm
=> nO(A) = 1,5.0,1 + 0,02 + 2.0,08 – 0,1 = 0,23 mol
Đặt nO2 và nO3 lần lượt là x và y mol
=> Bảo toàn O => 2x + 3y = 0,23 (1)
Lại có mA = 32x + 48y = 20.dA/H2.(x+ y) = 40(x+y) (2)
Từ (1) và (2) => x = y = 0,046 mol
=>V = 2,0608 l
=>B
Câu hỏi liên quan
-

Cho hỗn hợp X gồm ancol metylic, etylen glicol và glixeron. Đốt cháy hoàn toàn m gam X thu được 6,72 lít khí CO2 (đktc). Cũng m gam X trên cho tác dụng với Na dư thu được tối đa V lít khí H2 (đktc). Giá trị của V là
-

Công thức hóa học của clorua vôi là
-

Este X (MX =103 đvC) được điều chế từ một ancol đơn chức ( có tỉ khối hơi so với oxi lớn hơn 1) và một amino axit. Cho 25,75 gam X phản ứng hết với 300ml dung dich NaOH 1M, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn. Giá trị m là
-

Đốt cháy hoàn toàn 0,1 mol este X thu được 0,3 mol khí CO2 và 0,3 mol H2O. Nếu cho 0,1 mol X tác dụng hết với NaOH thì thu được 8,2 gam muối. X là
-

Trong công nghiệp, amoniac được điều chế từ nitơ và hiđrô bằng phương pháp tổng hợp: N2 (k) + 3H2 (k) <=> 2NH3 (k). Phản ứng theo chiều thuận là phản ứng tỏa nhiệt. Về lý thuyết, cân bằng trên sẽ dịch chuyển về phía tạo thành amoniac nếu
-

Đốt cháy hoàn toàn 0,3 gam hợp chất X có tỉ khối hơi so với hiđro bằng 30, sản phẩm tạo ra chỉ gồm 224ml khí CO2 (đktc) và 0,18 gam H20. Chất X vừa phản ứng được với NaOH, vừa có phản ứng tráng gương. Vậy X là
-

Hợp chất X có công thức tổng quát (CxH4Ox)n thuộc loại axit no đa chức ,mạch hở. Giá trị của x là n tương ứng là
-

Hiđrocacbon X có khối lượng mol bằng 100 gam. Cho X tác dụng với clo tạo ra hỗn hợp 3 dẫn xuất monoclo là đồng phân của nhau. Có bao nhiêu chất X thỏa mãn điều kiện trên?
-

Có hai hi đrocacbon A, B đều là chất khí ở điều kiện thường, không phải là đồng phân của nhau.Khi đốt cháy hoàn toàn, mỗi chất đều tạo ra số mol nước gấp 3 lần số mol mỗi chất đã cháy. A và B thỏa mãn sơ đồ chuyển hóa sau: A
![\xrightarrow[600^{0}C]{Fe}](https://luyentap365.com/wp-content/picture/learning/exam/2013/1101/164_230_1.gif) X → Y → B → Cao su buna. Trong đó X, Y có cùng số lượng nguyên tử cacbon trong phân tử. Vậy Y là
X → Y → B → Cao su buna. Trong đó X, Y có cùng số lượng nguyên tử cacbon trong phân tử. Vậy Y là -

Hòa tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al4C3 vào dung dịch KOH (dư), thu được a mol hỗn hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Giá trị của a là
