Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X gần nhất với giá trị nào sau đây?

Câu hỏi
Nhận biếtCho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X gần nhất với giá trị nào sau đây?
Đáp án đúng: D
Lời giải của Luyện Tập 365
Do Y chỉ chứa muối sunfat => NO3 chuyển hết sang khí NO ( khí hóa nâu trong không khí)
Mặt khác sau phản wsnsng thu được hỗn hợp khí => có H2
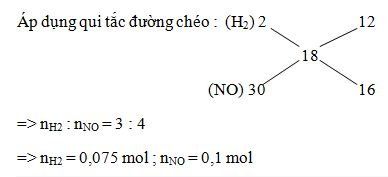
Ta có nH+ = 2nH2 + 4nNO + 10nNH4+ ( nếu có) + 2nO
=> 10nNH4+ + 2nO = 0,9 mol (*)
=> Bảo toàn N : nNO3 = nNO + nNH4+ = 0,1 + nNH4+
Có mmuối sunfat = mion KL + mSO4+ mNH4+
=> mion KL = 96,55 – 0,725.96 – 18nNH4+ = 26,95 – 18nNH4+
=> mX - mion KL = mO + mNO3
=> 38,55 – ( 26,95 – 18nNH4+) = 16nO + 62.( nNH4+ + 0,1)
=> 44nNH4+ + 16nO = 5,4 (**)
Từ (*) và (**) => nNH4+ = 0,05 ; nO = 0,2 = nZnO
=> Bảo toàn N : nNO3 = 0,15 mol => nFe(NO3)2 = 0,075 mol
=> Bảo toàn e : 2nMg + 3nAl = 3nNO + 2nH2 + 8nNH4+
=> 2nMg + 3nAl = 0,775
( Do Mg và Al tính khử mạnh hơn nên sẽ phản ứng với NO3- trước Fe2+ ; tuy nhiên do tạo khí H2 chứng tỏ khi hết NO3 nhưng kim loại vẫn dư => Fe2+ không bị oxi hóa )
=> mMg + mAl = 24nMg + 27nAl = 8,85g (2)
Từ (1) và (2) => nMg = 0,2 mol ; nAl = 0,15 mol
=> %nMg(X) = 32% gần nhất với giá trị 30%
=>D
Do Y chỉ chứa muối sunfat => NO3 chuyển hết sang khí NO ( khí hóa nâu trong không khí)
Mặt khác sau phản wsnsng thu được hỗn hợp khí => có H2

Ta có nH+ = 2nH2 + 4nNO + 10nNH4+ ( nếu có) + 2nO
=> 10nNH4+ + 2nO = 0,9 mol (*)
=> Bảo toàn N : nNO3 = nNO + nNH4+ = 0,1 + nNH4+
Có mmuối sunfat = mion KL + mSO4+ mNH4+
=> mion KL = 96,55 – 0,725.96 – 18nNH4+ = 26,95 – 18nNH4+
=> mX - mion KL = mO + mNO3
=> 38,55 – ( 26,95 – 18nNH4+) = 16nO + 62.( nNH4+ + 0,1)
=> 44nNH4+ + 16nO = 5,4 (**)
Từ (*) và (**) => nNH4+ = 0,05 ; nO = 0,2 = nZnO
=> Bảo toàn N : nNO3 = 0,15 mol => nFe(NO3)2 = 0,075 mol
=> Bảo toàn e : 2nMg + 3nAl = 3nNO + 2nH2 + 8nNH4+
=> 2nMg + 3nAl = 0,775
( Do Mg và Al tính khử mạnh hơn nên sẽ phản ứng với NO3- trước Fe2+ ; tuy nhiên do tạo khí H2 chứng tỏ khi hết NO3 nhưng kim loại vẫn dư => Fe2+ không bị oxi hóa )
=> mMg + mAl = 24nMg + 27nAl = 8,85g (2)
Từ (1) và (2) => nMg = 0,2 mol ; nAl = 0,15 mol
=> %nMg(X) = 32% gần nhất với giá trị 30%
=>D
Câu hỏi liên quan
-

Hiđrocacbon X có khối lượng mol bằng 100 gam. Cho X tác dụng với clo tạo ra hỗn hợp 3 dẫn xuất monoclo là đồng phân của nhau. Có bao nhiêu chất X thỏa mãn điều kiện trên?
-

Khối lượng của tinh bột cần dùng trong quá trình lên men để tạo thành 5 lít ancol etylic 460 là (biết hiệu suất của cả quá trình là 72% và khối lượng riêng của ancol là 0,8g/ml)
-

Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai ancol đơn chức, cùng dãy đồng đẳng, thu được 15,68 lít CO2 (đktc) và 17,1 gam nước. Mặt khác, thực hiện phản ứng este hóa m gam X với 15,6 gam axit axetic, thu được a gam este. Biết hiệu suất phản ứng este hóa của hai ancol đều bằng 60%. Giá trị của a là
-

Dung dịch NaHCO3 trong nước
-

Công thức hóa học của clorua vôi là
-

Cho hỗn hợp X gồm ancol metylic, etylen glicol và glixeron. Đốt cháy hoàn toàn m gam X thu được 6,72 lít khí CO2 (đktc). Cũng m gam X trên cho tác dụng với Na dư thu được tối đa V lít khí H2 (đktc). Giá trị của V là
-

Cho 21 gam hỗn hợp gồm glyxin và axit axetic tác dụng vừa đủ với dung dịch KOH, thu được dung dịch X chứa 32,4 gam muối. Cho X tác dụng với dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là
-

Cho các phương trình phản ứng: Fe + X → FeCl2 +... Chất X nào sau đây chọn không đúng?
-

Hòa tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al4C3 vào dung dịch KOH (dư), thu được a mol hỗn hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Giá trị của a là
-

Trong các chất HF, HCl, HBr và HI thì
