Đun nóng hỗn hợp gồm 1 mol HCOOH, 1 mol CH3COOH và 2 mol C2H5OH ở toC (trong bình kín dung tích không đổi)đến trạng thái cân bằng thì thu được 0,6 mol HCOOC2H5 và 0,4 mol CH3COOC2H5. Nếu đun nóng hỗn hợp gồm 1 mol HCOOH, 3 mol CH3COOH và a mol C2H5OH ở điều kiện như trên đến trạng thái cân bằng thì thu được 0,8 mol HCOOC2H5. Giá trị của a là:

Câu hỏi
Nhận biếtĐun nóng hỗn hợp gồm 1 mol HCOOH, 1 mol CH3COOH và 2 mol C2H5OH ở toC (trong bình kín dung tích không đổi)đến trạng thái cân bằng thì thu được 0,6 mol HCOOC2H5 và 0,4 mol CH3COOC2H5. Nếu đun nóng hỗn hợp gồm 1 mol HCOOH, 3 mol CH3COOH và a mol C2H5OH ở điều kiện như trên đến trạng thái cân bằng thì thu được 0,8 mol HCOOC2H5. Giá trị của a là:
Đáp án đúng: B
Lời giải của Luyện Tập 365
Gọi K1 và K2 lần lượt là hằng số cân bằng của phản ứng este hóa giữa axit HCOOH và CH3COOH với C2H5OHTN1:
HCOOH + C2H5OH 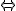 HCOOC2H5 + H2O(1)
HCOOC2H5 + H2O(1)
CH3COOH + C2H5OH 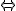 CH3COOC2H5 + H2O(2)
CH3COOC2H5 + H2O(2)
tính được: K1 = (0,6x1)/(0,4x1) = 3/2K2 = (0,4x1)/(0,6x1) = 2/3
tổng số mol H2O: nH2O= 0,4+0,6 =1mol = nC2H5OH pư
nC2H5OH dư= 2-(0,4+0,6) = 1mol
TN2: Gọi x là số mol CH3COOH đã phản ứng
HCOOH + C2H5OH 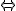 HCOOC2H5 + H2O (3)
HCOOC2H5 + H2O (3)
CH3COOH + C2H5OH 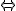 CH3COOC2H5 +H2O (4)
CH3COOC2H5 +H2O (4)
tính được: K1= [0,8(0,8+x)] : [(1-0,8)(a-0,8-x)]
K2= [x(0,8+x)] : [(3-x)(a-0,8-x)]
lập tỉ lệ: K1 : K2 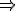 x=1,92mol và a=9,97mol
x=1,92mol và a=9,97mol
Gọi K1 và K2 lần lượt là hằng số cân bằng của phản ứng este hóa giữa axit HCOOH và CH3COOH với C2H5OHTN1:
HCOOH + C2H5OH 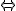 HCOOC2H5 + H2O(1)
HCOOC2H5 + H2O(1)
CH3COOH + C2H5OH 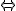 CH3COOC2H5 + H2O(2)
CH3COOC2H5 + H2O(2)
tính được: K1 = (0,6x1)/(0,4x1) = 3/2K2 = (0,4x1)/(0,6x1) = 2/3
tổng số mol H2O: nH2O= 0,4+0,6 =1mol = nC2H5OH pư
nC2H5OH dư= 2-(0,4+0,6) = 1mol
TN2: Gọi x là số mol CH3COOH đã phản ứng
HCOOH + C2H5OH 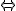 HCOOC2H5 + H2O (3)
HCOOC2H5 + H2O (3)
CH3COOH + C2H5OH 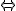 CH3COOC2H5 +H2O (4)
CH3COOC2H5 +H2O (4)
tính được: K1= [0,8(0,8+x)] : [(1-0,8)(a-0,8-x)]
K2= [x(0,8+x)] : [(3-x)(a-0,8-x)]
lập tỉ lệ: K1 : K2 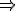 x=1,92mol và a=9,97mol
x=1,92mol và a=9,97mol
Câu hỏi liên quan
-

Hòa tan hết 7,2 gam hỗn hợp X gồm hai muối cacbonat của hai kim loại kế tiếp nhau trong nhóm IIA bằng dung dịch H2SO4 loãng, thu được khí Y. Cho toàn bộ khí Y hấp thụ hết bởi dung dịch Ba(OH)2 dư thu được 15,76 gam kết tủa. Hai kim loại ban đầu là
-

Đốt cháy hoàn toàn 0,1 mol este X thu được 0,3 mol khí CO2 và 0,3 mol H2O. Nếu cho 0,1 mol X tác dụng hết với NaOH thì thu được 8,2 gam muối. X là
-

Hòa tan 7,02 gam hỗn hợp gồm mantozơ và glucozơ vào nước rồi cho tác dụng hết với dung dịch AgNO3 dư trong NH3 thu được 6,48 gam Ag. Phần trăm theo khối lượng của glucozơ trong hỗn hợp ban đầu là
-

Cho các phương trình phản ứng: Fe + X → FeCl2 +... Chất X nào sau đây chọn không đúng?
-

Cho hỗn hợp X gồm ancol metylic, etylen glicol và glixeron. Đốt cháy hoàn toàn m gam X thu được 6,72 lít khí CO2 (đktc). Cũng m gam X trên cho tác dụng với Na dư thu được tối đa V lít khí H2 (đktc). Giá trị của V là
-

Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai ancol đơn chức, cùng dãy đồng đẳng, thu được 15,68 lít CO2 (đktc) và 17,1 gam nước. Mặt khác, thực hiện phản ứng este hóa m gam X với 15,6 gam axit axetic, thu được a gam este. Biết hiệu suất phản ứng este hóa của hai ancol đều bằng 60%. Giá trị của a là
-

Đun nóng xenlulozơ với hỗn hợp HNO3 và H2SO4 đặc, thu được chất dễ cháy, nổ mạnh không có khói nên được dùng làm thuốc súng không khói. Sản phẩm đó là
-

Nhận định nào dưới đây là đúng?
-

Chia m gam hỗn hợp gồm Na2O và Al2O3 thành 2 phần đều nhau: - Phần 1: Hòa tan trong nước dư thu được 1,02 gam chất rắn không tan - Phần 2: Hòa tan hết trong dung dịch HCl 1M thì cần vừa đủ 140ml dung dịch HCl. Khối lượng hỗn hợp ban đầu m có giá trị bằng
-

Este X (MX =103 đvC) được điều chế từ một ancol đơn chức ( có tỉ khối hơi so với oxi lớn hơn 1) và một amino axit. Cho 25,75 gam X phản ứng hết với 300ml dung dich NaOH 1M, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn. Giá trị m là
