(ĐHKA _ 2012) Điện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 12,6 gam Fe vào Y , sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5) . Giá trị của t là

Câu hỏi
Nhận biết(ĐHKA _ 2012) Điện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 12,6 gam Fe vào Y , sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5) . Giá trị của t là
Đáp án đúng: C
Lời giải của Luyện Tập 365
4AgNO3 + 2H2O 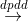 4Ag + O2 + 4HNO3
4Ag + O2 + 4HNO3
x x x
Sau phản ứng có hỗn hợp kim loại là Ag và Fe dư. Vậy dung dịch Y gồm HNO3 và AgNO3 còn. Do Fe dư nên sau phản ứng tạo Fe2+.
Fe 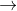 Fe2+ + 2e 4H+ + NO3- + 3e
Fe2+ + 2e 4H+ + NO3- + 3e 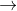 NO + 2H2O
NO + 2H2O
a 2a x 0,75x
Ag+ + 1e 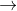 Ag
Ag
(0,15 - x) (0,15-x) (0,15-x)
=> 2a = 0,75x + 0,15 - x => 2a + 0,25x = 0,15 (1)
Mặt khác: nFe còn = (0,225 - a) ; nAg = (0,15-x)
=> mKL = 56.(0,225 - a) + 108.(0,15 - x) = 14,5 (2)
Giải hệ (1)(2) => a = 0,0625 mol; x = 0,1 mol
Từ biểu thức Faraday: nAg = 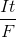 => t =
=> t = 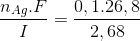 = 1 giờ
= 1 giờ
=> Đáp án C
4AgNO3 + 2H2O 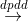 4Ag + O2 + 4HNO3
4Ag + O2 + 4HNO3
x x x
Sau phản ứng có hỗn hợp kim loại là Ag và Fe dư. Vậy dung dịch Y gồm HNO3 và AgNO3 còn. Do Fe dư nên sau phản ứng tạo Fe2+.
Fe 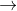 Fe2+ + 2e 4H+ + NO3- + 3e
Fe2+ + 2e 4H+ + NO3- + 3e  NO + 2H2O
NO + 2H2O
a 2a x 0,75x
Ag+ + 1e  Ag
Ag
(0,15 - x) (0,15-x) (0,15-x)
=> 2a = 0,75x + 0,15 - x => 2a + 0,25x = 0,15 (1)
Mặt khác: nFe còn = (0,225 - a) ; nAg = (0,15-x)
=> mKL = 56.(0,225 - a) + 108.(0,15 - x) = 14,5 (2)
Giải hệ (1)(2) => a = 0,0625 mol; x = 0,1 mol
Từ biểu thức Faraday: nAg = 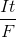 => t =
=> t = 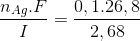 = 1 giờ
= 1 giờ
=> Đáp án C
Câu hỏi liên quan
-

Trong công nghiệp, amoniac được điều chế từ nitơ và hiđrô bằng phương pháp tổng hợp: N2 (k) + 3H2 (k) <=> 2NH3 (k). Phản ứng theo chiều thuận là phản ứng tỏa nhiệt. Về lý thuyết, cân bằng trên sẽ dịch chuyển về phía tạo thành amoniac nếu
-

Este X (MX =103 đvC) được điều chế từ một ancol đơn chức ( có tỉ khối hơi so với oxi lớn hơn 1) và một amino axit. Cho 25,75 gam X phản ứng hết với 300ml dung dich NaOH 1M, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn. Giá trị m là
-

Cho các phương trình phản ứng: Fe + X → FeCl2 +... Chất X nào sau đây chọn không đúng?
-

Nhận định nào dưới đây là đúng?
-

Đun nóng xenlulozơ với hỗn hợp HNO3 và H2SO4 đặc, thu được chất dễ cháy, nổ mạnh không có khói nên được dùng làm thuốc súng không khói. Sản phẩm đó là
-

Cho các chất sau C6H5-NH2 (X); Cl-C6H4 -NH2 (Y); O2N-C6H4 -NH2 (Z); CH3-C6H4-NH2 (T). Chất có tính bazơ mạnh nhất là:
-

Cho hỗn hợp X gồm ancol metylic, etylen glicol và glixeron. Đốt cháy hoàn toàn m gam X thu được 6,72 lít khí CO2 (đktc). Cũng m gam X trên cho tác dụng với Na dư thu được tối đa V lít khí H2 (đktc). Giá trị của V là
-

Đốt cháy hoàn toàn 0,1 mol este X thu được 0,3 mol khí CO2 và 0,3 mol H2O. Nếu cho 0,1 mol X tác dụng hết với NaOH thì thu được 8,2 gam muối. X là
-

Thêm rất từ từ dung dịch chứa 0,3 mol HCl vào 400ml dung dịch Na2CO3 0,5M đến khi kết thúc phản ứng thu được dung dịch X và khí Y. Thêm tiếp nước vôi trong dư vào dung dịch X, sau phản ứng khối lượng kết tủa thu được là
-

Trong phân tử aminoaxit X có một nhóm amino và một nhóm cacboxyl. Cho 15,0 gam X tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được 19,4 gam muối khan. Công thức của X là:
