Điện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 1,34A( Hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y, và khí Z. Cho 13 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,9 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là

Câu hỏi
Nhận biếtĐiện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 1,34A( Hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y, và khí Z. Cho 13 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,9 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là
Đáp án đúng: C
Lời giải của Luyện Tập 365
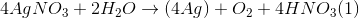
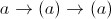
Dung dịch Y:HNO3 , AgNO3 dư (vì khối lượng kim loại sau phản ứng lớn hơn 13)
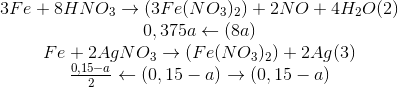
Sau phản ứng (3) Fe còn dư vì thu được hỗn hợp kim loại=> phản ứng với
HNO3coi như chỉ tạo muối sắt (II)
(0,15 x a) x 108 -(0,375a + 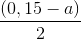 ) x 56 = 14,9 - 13,0
) x 56 = 14,9 - 13,0
=> a=0,1 (mol).
=> Số mol electron trao đổi ở (1)=0,1=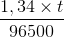 => t =
=> t = 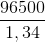 = =7200(s)
= =7200(s)
=> Đáp án C
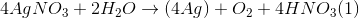
Dung dịch Y:HNO3 , AgNO3 dư (vì khối lượng kim loại sau phản ứng lớn hơn 13)
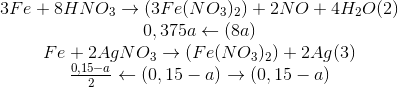
Sau phản ứng (3) Fe còn dư vì thu được hỗn hợp kim loại=> phản ứng với
HNO3coi như chỉ tạo muối sắt (II)
(0,15 x a) x 108 -(0,375a + 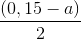 ) x 56 = 14,9 - 13,0
) x 56 = 14,9 - 13,0
=> a=0,1 (mol).
=> Số mol electron trao đổi ở (1)=0,1=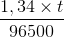 => t =
=> t = 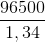 = =7200(s)
= =7200(s)
=> Đáp án C
Câu hỏi liên quan
-

Trong phân tử aminoaxit X có một nhóm amino và một nhóm cacboxyl. Cho 15,0 gam X tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được 19,4 gam muối khan. Công thức của X là:
-

Cho AgNO3 vào từng dung dịch NaF, NaCl, NaBr, NaI thì muối Halogen tạo được kết tủa là
-

Hòa tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al4C3 vào dung dịch KOH (dư), thu được a mol hỗn hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Giá trị của a là
-

Trong các chất HF, HCl, HBr và HI thì
-

Do có tác dụng diệt khuẩn, đặc biệt là vi khuẩn gây thối rữa nên dung dịch của hợp chất X được dùng để ngâm xác động vật, thuộc da, tấy uế... X là
-

Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 dư vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là
-

Cho 21 gam hỗn hợp gồm glyxin và axit axetic tác dụng vừa đủ với dung dịch KOH, thu được dung dịch X chứa 32,4 gam muối. Cho X tác dụng với dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là
-

Hòa tan 7,02 gam hỗn hợp gồm mantozơ và glucozơ vào nước rồi cho tác dụng hết với dung dịch AgNO3 dư trong NH3 thu được 6,48 gam Ag. Phần trăm theo khối lượng của glucozơ trong hỗn hợp ban đầu là
-

Oxi hóa 4,48 lít C2H4 (ở đktc) bằng O2 (xúc tác PdCl2, CuCl2), thu được chất X đơn chức. Toàn bộ lượng chất X trên cho tác dụng với HCN (dư) thì được 7,1 gam CH3CH(CN)OH (Xianohiđrin). Hiệu suất quá trình tạo CH3CH(CN)OH từ C2H4 là
-

Thêm rất từ từ dung dịch chứa 0,3 mol HCl vào 400ml dung dịch Na2CO3 0,5M đến khi kết thúc phản ứng thu được dung dịch X và khí Y. Thêm tiếp nước vôi trong dư vào dung dịch X, sau phản ứng khối lượng kết tủa thu được là
