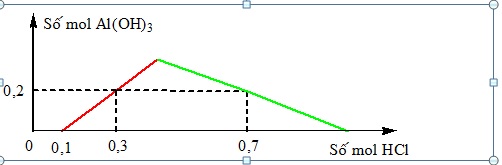
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2 [hoặc Ba(AlO2)2], kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Giá trị của x và y lần lượt là:
A. 0,10 và 0,30 B. 0,05 và 0,15 C.
![Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2 Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2](https://luyentap365.com/wp-content/themes/luyentap365/assets/images/tong-hop-cac-cau-hoi-on-tap-luyen-thi.png)
Câu hỏi
Nhận biếtKhi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm x mol Ba(OH)2 và y mol Ba[Al(OH)4]2 [hoặc Ba(AlO2)2], kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Giá trị của x và y lần lượt là:
A. 0,10 và 0,30 B. 0,05 và 0,15 C.

Đáp án đúng: B
Lời giải của Luyện Tập 365
Phương pháp :
Ban đầu H+ tác dụng với OH- nên chưa tạo kết tủa ngay. Khi lượng két tủa bắt đầu tang chính là khi OH- hết
Đỉnh của đồ thị là lượng kết tủa lớn nhất
Lời giải :
Dd có OH- = 2x mol và AlO2- = 2y mol
Ban đầu thì H+ tác dụng với OH- mất 0,1 mol thì 2x=0,1 => x=0,05 mol
Sau đó H+ + AlO2- + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Tại lúc HCl dùng là 0,7 mol thì kết tủa được tạo tối đa tan một phần còn 0,2 mol
Khi đó nHCl = 0,1 + 2y + 3(2y-0,2) => y=0,15
Phương pháp :
Ban đầu H+ tác dụng với OH- nên chưa tạo kết tủa ngay. Khi lượng két tủa bắt đầu tang chính là khi OH- hết
Đỉnh của đồ thị là lượng kết tủa lớn nhất
Lời giải :
Dd có OH- = 2x mol và AlO2- = 2y mol
Ban đầu thì H+ tác dụng với OH- mất 0,1 mol thì 2x=0,1 => x=0,05 mol
Sau đó H+ + AlO2- + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Tại lúc HCl dùng là 0,7 mol thì kết tủa được tạo tối đa tan một phần còn 0,2 mol
Khi đó nHCl = 0,1 + 2y + 3(2y-0,2) => y=0,15
Câu hỏi liên quan
-

Nung nóng một hỗn hợp gồm CaCO3 và MgO tới khối lượng không đổi, thì số gam chất rắn còn lại chỉ bằng
 số gam hỗn hợp trước khi nung. Vậy % theo khối lượng của CaCO3 trong hỗn hợp ban đầu là
số gam hỗn hợp trước khi nung. Vậy % theo khối lượng của CaCO3 trong hỗn hợp ban đầu là -

Khối lượng của tinh bột cần dùng trong quá trình lên men để tạo thành 5 lít ancol etylic 460 là (biết hiệu suất của cả quá trình là 72% và khối lượng riêng của ancol là 0,8g/ml)
-

Este X (MX =103 đvC) được điều chế từ một ancol đơn chức ( có tỉ khối hơi so với oxi lớn hơn 1) và một amino axit. Cho 25,75 gam X phản ứng hết với 300ml dung dich NaOH 1M, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn. Giá trị m là
-

Hòa tan hết 7,2 gam hỗn hợp X gồm hai muối cacbonat của hai kim loại kế tiếp nhau trong nhóm IIA bằng dung dịch H2SO4 loãng, thu được khí Y. Cho toàn bộ khí Y hấp thụ hết bởi dung dịch Ba(OH)2 dư thu được 15,76 gam kết tủa. Hai kim loại ban đầu là
-

Hòa tan 7,02 gam hỗn hợp gồm mantozơ và glucozơ vào nước rồi cho tác dụng hết với dung dịch AgNO3 dư trong NH3 thu được 6,48 gam Ag. Phần trăm theo khối lượng của glucozơ trong hỗn hợp ban đầu là
-

Hiđrocacbon X có khối lượng mol bằng 100 gam. Cho X tác dụng với clo tạo ra hỗn hợp 3 dẫn xuất monoclo là đồng phân của nhau. Có bao nhiêu chất X thỏa mãn điều kiện trên?
-

Đốt cháy hoàn toàn 0,3 gam hợp chất X có tỉ khối hơi so với hiđro bằng 30, sản phẩm tạo ra chỉ gồm 224ml khí CO2 (đktc) và 0,18 gam H20. Chất X vừa phản ứng được với NaOH, vừa có phản ứng tráng gương. Vậy X là
-

Cho các chất sau C6H5-NH2 (X); Cl-C6H4 -NH2 (Y); O2N-C6H4 -NH2 (Z); CH3-C6H4-NH2 (T). Chất có tính bazơ mạnh nhất là:
-

Hai chất được dùng để làm mềm nước cứng vĩnh cửu là:
-

Cho AgNO3 vào từng dung dịch NaF, NaCl, NaBr, NaI thì muối Halogen tạo được kết tủa là
