Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là

Câu hỏi
Nhận biếtHỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Đáp án đúng: A
Lời giải của Luyện Tập 365
Phương pháp:
Sau khi nhiệt nhôm thu sản phẩm có khả năng phản ứng với NaOH nên phản ứng có Al dư
Thành phần các chất trong từng phần cũng tương tự như thành phần trong hỗn hợp sau phản ứng nên ta lập được tỉ lệ Fe và Al trong hỗn hợp sau phản ứng
Lập phương trình về tỉ lệ Fe và Al có liên quan đến m để giải m
Lời giải :
Hỗn hợp X có 0,07 mol Fe, 0,1 mol Fe2O3 và có m g Al
Fe2O3 + 2Al → 2 Fe + Al2O3
x mol 2x 2x x
Phấn 1 : nH2 = 4a = nFe + 3nAl:2
Phần 2: nH2 = a => nAl =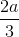
Suy ra từng phần có 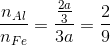
Suy ra hỗn hợp sau khi nhiệt nhôm có tỉ lệ số mol Al :Fe =2:9
Suy ra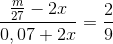
Vì phản ứng sảy ra hoàn toàn nên Al dư thì Fe2O3 hết thì x = 0,1 mol
nên m=7,02
Phương pháp:
Sau khi nhiệt nhôm thu sản phẩm có khả năng phản ứng với NaOH nên phản ứng có Al dư
Thành phần các chất trong từng phần cũng tương tự như thành phần trong hỗn hợp sau phản ứng nên ta lập được tỉ lệ Fe và Al trong hỗn hợp sau phản ứng
Lập phương trình về tỉ lệ Fe và Al có liên quan đến m để giải m
Lời giải :
Hỗn hợp X có 0,07 mol Fe, 0,1 mol Fe2O3 và có m g Al
Fe2O3 + 2Al → 2 Fe + Al2O3
x mol 2x 2x x
Phấn 1 : nH2 = 4a = nFe + 3nAl:2
Phần 2: nH2 = a => nAl =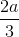
Suy ra từng phần có 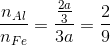
Suy ra hỗn hợp sau khi nhiệt nhôm có tỉ lệ số mol Al :Fe =2:9
Suy ra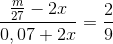
Vì phản ứng sảy ra hoàn toàn nên Al dư thì Fe2O3 hết thì x = 0,1 mol
nên m=7,02
Câu hỏi liên quan
-

Hòa tan 7,02 gam hỗn hợp gồm mantozơ và glucozơ vào nước rồi cho tác dụng hết với dung dịch AgNO3 dư trong NH3 thu được 6,48 gam Ag. Phần trăm theo khối lượng của glucozơ trong hỗn hợp ban đầu là
-

Cho 21 gam hỗn hợp gồm glyxin và axit axetic tác dụng vừa đủ với dung dịch KOH, thu được dung dịch X chứa 32,4 gam muối. Cho X tác dụng với dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là
-

Hiđrocacbon X có khối lượng mol bằng 100 gam. Cho X tác dụng với clo tạo ra hỗn hợp 3 dẫn xuất monoclo là đồng phân của nhau. Có bao nhiêu chất X thỏa mãn điều kiện trên?
-

Trong các chất HF, HCl, HBr và HI thì
-

Do có tác dụng diệt khuẩn, đặc biệt là vi khuẩn gây thối rữa nên dung dịch của hợp chất X được dùng để ngâm xác động vật, thuộc da, tấy uế... X là
-

Cho các chất sau C6H5-NH2 (X); Cl-C6H4 -NH2 (Y); O2N-C6H4 -NH2 (Z); CH3-C6H4-NH2 (T). Chất có tính bazơ mạnh nhất là:
-

Nung nóng một hỗn hợp gồm CaCO3 và MgO tới khối lượng không đổi, thì số gam chất rắn còn lại chỉ bằng
 số gam hỗn hợp trước khi nung. Vậy % theo khối lượng của CaCO3 trong hỗn hợp ban đầu là
số gam hỗn hợp trước khi nung. Vậy % theo khối lượng của CaCO3 trong hỗn hợp ban đầu là -

Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 dư vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là
-

Trong phân tử aminoaxit X có một nhóm amino và một nhóm cacboxyl. Cho 15,0 gam X tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được 19,4 gam muối khan. Công thức của X là:
-

Công thức hóa học của clorua vôi là
