Đốt cháy hoàn toàn 6,72 lít hỗn hợp gồm 2 hidrocacbon no mạch hở đồng đẳng liên tiếp thu được hỗn hợp sản phẩm cháy. Dẫn toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư thì thấy khối lượng dung dịch giảm 25g. Phân tử khối của ankan có số cacbon lớn hơn là:

Câu hỏi
Nhận biếtĐốt cháy hoàn toàn 6,72 lít hỗn hợp gồm 2 hidrocacbon no mạch hở đồng đẳng liên tiếp thu được hỗn hợp sản phẩm cháy. Dẫn toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư thì thấy khối lượng dung dịch giảm 25g. Phân tử khối của ankan có số cacbon lớn hơn là:
Đáp án đúng: C
Phương pháp giải
- Khi đề cho 2 hidrocacbon đồng đẳng kế tiếp, ta có thể nghĩ đến phương pháp đặt công thức trung bình của 2 hidrocabon đó.
- Khi đốt cháy ankan thì : nankan = nH2O – nCO2
- Khi đề cho 2 hidrocacbon đồng đẳng kế tiếp, ta có thể nghĩ đến phương pháp đặt công thức trung bình của 2 hidrocabon đó.
- Khi đốt cháy ankan thì : nankan = nH2O – nCO2
Lời giải của Luyện Tập 365
Sản phẩm cháy gồm CO2 và H2O của hidrocacbon no mạch hở ⟹ ankan
⟹ nH2O - nCO2 = nhidrocacbon = 0,3 mol
mdd giảm = mCaCO3 - (mCO2 + mH2O) = 25g
Mà Ca(OH)2 dư nên nCO2 = nCaCO3 ⟹ 56nCO2 - 18nH2O = 25g
⟹ nCO2 = 0,8; nH2O =1,1 mol
Gọi số C trung bình của 2 hidrocacbon là n
⟹ nCO2 = nHC.n ⟹ n = 2,67
⟹ hidrocacbon có số C lớn hơn là C3H8 (M = 44g).
Sản phẩm cháy gồm CO2 và H2O của hidrocacbon no mạch hở ⟹ ankan
⟹ nH2O - nCO2 = nhidrocacbon = 0,3 mol
mdd giảm = mCaCO3 - (mCO2 + mH2O) = 25g
Mà Ca(OH)2 dư nên nCO2 = nCaCO3 ⟹ 56nCO2 - 18nH2O = 25g
⟹ nCO2 = 0,8; nH2O =1,1 mol
Gọi số C trung bình của 2 hidrocacbon là n
⟹ nCO2 = nHC.n ⟹ n = 2,67
⟹ hidrocacbon có số C lớn hơn là C3H8 (M = 44g).
Câu hỏi liên quan
-

(1đ)
Cho Kb của CH3COO- ở 25oC là 5,56x10-10. Tính pH của dung dịch CH3COONa 0,5M ở 25oC.
-

(3 điểm):
a. Cho 16,05 gam Fe(OH)3 tác dụng vừa đủ với V ml dung dịch HNO3 1M, thu được dung dịch chứa a gam muối. Viết phương trình phản ứng xảy ra, tìm các giá trị V và a.
b. Hòa tan hoàn toàn 10,08 gam kim loại Mg vào dung dịch HNO3 loãng, dư, thấy thoát ra 4,48 lít khí NO (ở đktc và là khí thoát ra duy nhất), tính khối lượng muối tan có trong dung dịch sau phản ứng.
-

(1,5đ)
Cho dung dịch HNO3 loãng lần lượt tác dụng với: dung dịch Ba(OH)2; kim loại Cu (NO là sản phẩm khử duy nhất).
Viết các phương trình hoá học dưới dạng phân tử và ion thu gọn. Nêu vai trò của HNO3 trong mỗi phản ứng.
-

(1đ)
Nhiệt phân hoàn toàn hỗn hợp X gồm KNO3 và Cu(NO3)2 thu được hỗn hợp khí Y có tỉ khối so với oxi là 1,25. Tính % khối lượng của KNO3 trong hỗn hợp X?
-

(3 điểm)
1. X là một hiđrocacbon. Hiđro hóa hoàn toàn X thì thu đuợc 3-etylhexan. Tỉ khối hơi của X so với Hiđro bằng 52. Nếu cho 10,4 gam X tác dụng hoàn toàn với lượng dư dung dịch bạc nitrat trong amoniac thì tạo được 31,8 gam một chất rắn có màu vàng nhạt. Lập công thức phân tử và viết các công thức cấu tạo có thể có của X.
2. Y là hỗn hợp gồm hidrocacbon CxHy (A) và H2. Sau khi đun nóng hỗn hợp Y với xúc tác Ni ta chỉ thu được một khí K duy nhất. Ở cùng điều kiện nhiệt độ và áp suất, tỷ khối của K so với H2 gấp ba lần tỷ khối hơi của Y so với H2. Mặt khác nếu đốt cháy hoàn toàn một lượng khác của K thu được 22 gam CO2 và 13,5 gam nước. Xác định công thức phân tử của A.
-

( 2 điểm):
Viết công thức cấu tạo của các hợp chất dị vòng sau đây:
a) 2-Metyl-5-phenylthiophen.
b) Axit 3-etylpirol-2-cacboxylic.
c) 2,6-Đi-tert-butylpiriđin.
d) Etyl piriđin-3-cacboxylat.
-

(1,5đ)
Cho dung dịch HNO3 loãng lần lượt tác dụng với: Al(OH)3; kim loại Zn (N2O là sản phẩm khử duy nhất).
Viết các phương trình hoá học dưới dạng phân tử và ion thu gọn. Nêu vai trò của HNO3 trong mỗi phản ứng.
-

( 2 điểm):
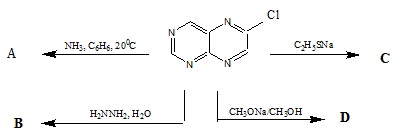
Viết các phương trình phản ứng thực hiện sơ đồ sau:
-

(1,5đ)
Dung dịch A gồm NaOH 0,8M và Ba(OH)2 0,6M. Dung dịch B (gồm HCl 0,04M và H2SO4) có pH = 1. Thêm V ml dung dịch B vào 100 ml dung dịch A để được dung dịch X có pH bằng 13. (coi thể tích dung dịch X bằng tổng thể tích dung dịch A và dung dịch B)
Tính V. Tính số gam kết tủa sinh ra trong thí nghiệm trên.
-

(3 điểm): a. Hoàn thành sơ đồ sau bằng các phương trình phản ứng:
N2
 NH3
NH3  NO
NO  NO2
NO2b. Phân biệt 3 dung dịch riêng biệt sau bằng phương pháp hoá học:
K2CO3,KCl, K2SO4
