Đốt cháy 5,6 gam Fe trong 1,12 lít O2 (đktc), sau một thời gian thu được hỗn hợp X gồm: FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối Fe(NO3)3 và V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là:

Câu hỏi
Nhận biếtĐốt cháy 5,6 gam Fe trong 1,12 lít O2 (đktc), sau một thời gian thu được hỗn hợp X gồm: FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hoàn toàn hỗn hợp X bằng dung dịch HNO3 dư, sau phản ứng thu được dung dịch Y chỉ chứa muối Fe(NO3)3 và V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là:
Đáp án đúng: A
Phương pháp giải
Quy đổi hỗn hợp thành Fe và O.
Áp dụng định luật bảo toàn electron: 3nFe = nNO2 + 2nO (vì phản ứng chỉ tạo muối Fe3+)
Quy đổi hỗn hợp thành Fe và O.
Áp dụng định luật bảo toàn electron: 3nFe = nNO2 + 2nO (vì phản ứng chỉ tạo muối Fe3+)
Lời giải của Luyện Tập 365
Ta có: nFe = 0,1 mol; nO2 = 0,05 mol
Quy hỗn hợp X về: 0,1 mol Fe và 0,1 mol O
Vì chỉ tạo Fe(NO3)3 => Bảo toàn e: 3nFe = nNO2 + 2nO => 3.0,1 = nNO2 + 2.0,1 => nNO2 = 0,1 mol
=> VNO2 = 2,24 lít
Ta có: nFe = 0,1 mol; nO2 = 0,05 mol
Quy hỗn hợp X về: 0,1 mol Fe và 0,1 mol O
Vì chỉ tạo Fe(NO3)3 => Bảo toàn e: 3nFe = nNO2 + 2nO => 3.0,1 = nNO2 + 2.0,1 => nNO2 = 0,1 mol
=> VNO2 = 2,24 lít
Câu hỏi liên quan
-

(1đ).
Hợp chất hữu cơ X (chứa C, H, O, N) có 46,67%N; 6,67%H về khối lượng. Đốt cháy hoàn toàn 3,6 gam X thu được 1,344 lít khí CO2 (đktc). Xác định công thức phân tử của X, biết X có công thức phân tử trùng với công thức đơn giản nhất.
-

(3 điểm):
a. Cho 16 gam Fe2O3 tác dụng vừa đủ với V ml dung dịch HNO3 1,5M, thu được dung dịch chứa a gam muối. Viết phương trình phản ứng xảy ra, tìm các giá trị V và a.
b. Hòa tan hoàn toàn 4,86 gam kim loại Al vào dung dịch HNO3 loãng, dư, thấy thoát ra 2,24 lít khí NO (ở đktc và là khí thoát ra duy nhất), tính khối lượng muối tan có trong dung dịch sau phản ứng.
-

(3 điểm):
a. Cho 16,05 gam Fe(OH)3 tác dụng vừa đủ với V ml dung dịch HNO3 1M, thu được dung dịch chứa a gam muối. Viết phương trình phản ứng xảy ra, tìm các giá trị V và a.
b. Hòa tan hoàn toàn 10,08 gam kim loại Mg vào dung dịch HNO3 loãng, dư, thấy thoát ra 4,48 lít khí NO (ở đktc và là khí thoát ra duy nhất), tính khối lượng muối tan có trong dung dịch sau phản ứng.
-

(2 điểm)
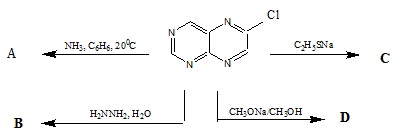
1. Xác định các chất A, B, D, E và viết các phương trình phản ứng thực hiện sơ đồ sau:

Biết rằng khi đốt cháy 0,1 mol E thu được 0,9 mol CO2
2. Một sơ đồ để điều chế cao su Buna như sau, xác định M và viết các phương trình phản ứng:
 Cao su Buna
Cao su Buna -

(1,5đ)
Khi hoà tan 18 gam hỗn hợp X gồm Al và Mg vào dung dịch HNO3 loãng vừa đủ thì thu được 2,24 lít (đktc) khí N2O và dung dịch Y. Cho dung dịch NaOH dư vào dung dịch Y đun nhẹ thấy có 2,8 lít khí NH3 (đktc) thoát ra.
Viết các phương trình hoá học và tính số gam mỗi kim loại có trong X.
-

(1,5đ).
Viết các phương trình hoá học (ghi rõ điều kiện – nếu có) để hoàn thành sơ đồ phản ứng sau:
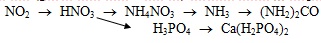
-

(1đ)
Cho Ka của CH3COOH ở 25oC là 1,8x10-5. Tính pH của dung dịch CH3COOH 0,5M ở 25oC.
-

(1,5đ)
Dung dịch A gồm NaOH 0,8M và Ba(OH)2 0,6M. Dung dịch B (gồm HCl 0,04M và H2SO4) có pH = 1. Thêm V ml dung dịch B vào 100 ml dung dịch A để được dung dịch X có pH bằng 13. (coi thể tích dung dịch X bằng tổng thể tích dung dịch A và dung dịch B)
Tính V. Tính số gam kết tủa sinh ra trong thí nghiệm trên.
-

(1,5đ)
Viết các phương trình hoá học (ghi rõ điều kiện – nếu có) để hoàn thành sơ đồ phản ứng sau:
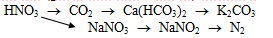
-

( 2 điểm):
Viết các phương trình phản ứng thực hiện sơ đồ sau: