(3 điểm)
1. Chọn chất phù hợp, viết phương trình (ghi rõ điều kiện phản ứng) thực hiện biến đổi sau về Nitơ và các hợp chất của nitơ :
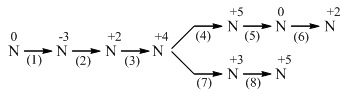 2. Hòa tan hoàn toàn 16,2 gam bột kim loại M hóa trị III vào 5 lít dung dịch HNO3 0,5M (d = 1,25g/ml). Sau khi phản ứng kết thúc thu được 2,8 lít (ở 0oC và 2 atm) hỗn hợp khí gồm NO, N2 . Trộn hỗn hợp khí này với lượng oxi vừa đủ thành hỗn hợp A, sau phản ứng thấy thể tích khí chỉ bằng 5/6 thể tích của hỗn hợp A.
Xác định nguyên tử khối và gọi tên kim loại M. Tính nồng độ % dung dịch HNO3 sau phản ứng.
2. Hòa tan hoàn toàn 16,2 gam bột kim loại M hóa trị III vào 5 lít dung dịch HNO3 0,5M (d = 1,25g/ml). Sau khi phản ứng kết thúc thu được 2,8 lít (ở 0oC và 2 atm) hỗn hợp khí gồm NO, N2 . Trộn hỗn hợp khí này với lượng oxi vừa đủ thành hỗn hợp A, sau phản ứng thấy thể tích khí chỉ bằng 5/6 thể tích của hỗn hợp A.
Xác định nguyên tử khối và gọi tên kim loại M. Tính nồng độ % dung dịch HNO3 sau phản ứng.

Câu hỏi
Nhận biết(3 điểm)
1. Chọn chất phù hợp, viết phương trình (ghi rõ điều kiện phản ứng) thực hiện biến đổi sau về Nitơ và các hợp chất của nitơ :

2. Hòa tan hoàn toàn 16,2 gam bột kim loại M hóa trị III vào 5 lít dung dịch HNO3 0,5M (d = 1,25g/ml). Sau khi phản ứng kết thúc thu được 2,8 lít (ở 0oC và 2 atm) hỗn hợp khí gồm NO, N2 . Trộn hỗn hợp khí này với lượng oxi vừa đủ thành hỗn hợp A, sau phản ứng thấy thể tích khí chỉ bằng 5/6 thể tích của hỗn hợp A.
Xác định nguyên tử khối và gọi tên kim loại M. Tính nồng độ % dung dịch HNO3 sau phản ứng.
Đáp án đúng:
Lời giải của Luyện Tập 365
1. Các phương trình phản ứng :
(1) N2 + 3H2 ![\xrightarrow[Fe]{500^{\circ},300atm}](https://luyentap365.com/wp-content/picture/learning/exam/2014/1124/v62773_864818_1.gif) 2NH3
2NH3
(2) 4NH3 + 5O2 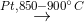 4NO + 6H2O
4NO + 6H2O
(3) 2NO + O2 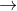 2NO2
2NO2
(4) 4NO2 + O2 + 2H2O 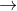 4HNO3
4HNO3
(5) 5Mg + 12 HNO3 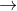 5Mg(NO3)2 + N2 + 6H2O
5Mg(NO3)2 + N2 + 6H2O
(6) N2 + O2 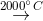 2NO
2NO
(7) 2NO2 + 2KOH 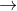 KNO2 + KNO3 + H2O
KNO2 + KNO3 + H2O
(8) 5KNO2 + 2KMnO4 + 3H2SO4 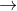 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
5KNO3 + K2SO4 + 2MnSO4 + 3H2O
2. a/ Phương trình phản ứng:
M + 4HNO3 → M(NO3)3 + NO + 2H2O (1)
a 4a a
10M + 36HNO3 → 10M(NO3)3 + 3N2 + 18 H2O (2)
b 3,6b 0,3b
2NO + O2 → 2NO2
a 0,5a a
số mol M = a + b = 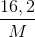 (I)
(I)
số mol hh (NO + N2) = a + 0,3b = 0,25 (II)
số mol hh A = a + 0,3b + 0,5a = 1,5a + 0,3b =  (a + 0,3b)
(a + 0,3b)
Suy ra 5a = b (III).
Giải hệ (I), (II), (III) ta được a = 0,1; b = 0,5 và M = 27 do đó M là Al
b/ Số mol HNO3 bđ = 5 .0,5 = 2,5
Số mol HNO3 pư = 4.0,1 + 3,6.0,5 = 2,2
Số mol HNO3 dư = 0,3 m HNO3 dư = 18,9 gam
khối lượng dung dịch sau pư = 5000 .1,25 + 16,2 –(28. 0,3. 0,5 + 30. 0,1)= 6259 g
Vậy C% HNO3 sau pư = 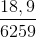 .100% = 0,3%
.100% = 0,3%
1. Các phương trình phản ứng :
(1) N2 + 3H2 ![\xrightarrow[Fe]{500^{\circ},300atm}](https://luyentap365.com/wp-content/picture/learning/exam/2014/1124/v62773_864818_1.gif) 2NH3
2NH3
(2) 4NH3 + 5O2 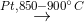 4NO + 6H2O
4NO + 6H2O
(3) 2NO + O2 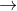 2NO2
2NO2
(4) 4NO2 + O2 + 2H2O 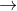 4HNO3
4HNO3
(5) 5Mg + 12 HNO3 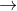 5Mg(NO3)2 + N2 + 6H2O
5Mg(NO3)2 + N2 + 6H2O
(6) N2 + O2 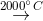 2NO
2NO
(7) 2NO2 + 2KOH 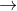 KNO2 + KNO3 + H2O
KNO2 + KNO3 + H2O
(8) 5KNO2 + 2KMnO4 + 3H2SO4 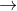 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
5KNO3 + K2SO4 + 2MnSO4 + 3H2O
2. a/ Phương trình phản ứng:
M + 4HNO3 → M(NO3)3 + NO + 2H2O (1)
a 4a a
10M + 36HNO3 → 10M(NO3)3 + 3N2 + 18 H2O (2)
b 3,6b 0,3b
2NO + O2 → 2NO2
a 0,5a a
số mol M = a + b = 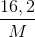 (I)
(I)
số mol hh (NO + N2) = a + 0,3b = 0,25 (II)
số mol hh A = a + 0,3b + 0,5a = 1,5a + 0,3b =  (a + 0,3b)
(a + 0,3b)
Suy ra 5a = b (III).
Giải hệ (I), (II), (III) ta được a = 0,1; b = 0,5 và M = 27 do đó M là Al
b/ Số mol HNO3 bđ = 5 .0,5 = 2,5
Số mol HNO3 pư = 4.0,1 + 3,6.0,5 = 2,2
Số mol HNO3 dư = 0,3 m HNO3 dư = 18,9 gam
khối lượng dung dịch sau pư = 5000 .1,25 + 16,2 –(28. 0,3. 0,5 + 30. 0,1)= 6259 g
Vậy C% HNO3 sau pư = 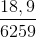 .100% = 0,3%
.100% = 0,3%
Câu hỏi liên quan
-

(1đ).
Hợp chất hữu cơ X (chứa C, H, O, N) có 46,67%N; 6,67%H về khối lượng. Đốt cháy hoàn toàn 3,6 gam X thu được 1,344 lít khí CO2 (đktc). Xác định công thức phân tử của X, biết X có công thức phân tử trùng với công thức đơn giản nhất.
-

(1,5đ)
Viết các phương trình hoá học (ghi rõ điều kiện – nếu có) để hoàn thành sơ đồ phản ứng sau:
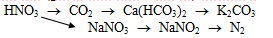
-

(2 điểm)
1. Xác định các chất A, B, D, E và viết các phương trình phản ứng thực hiện sơ đồ sau:

Biết rằng khi đốt cháy 0,1 mol E thu được 0,9 mol CO2
2. Một sơ đồ để điều chế cao su Buna như sau, xác định M và viết các phương trình phản ứng:
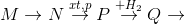 Cao su Buna
Cao su Buna -

(1đ)
Cho Ka của CH3COOH ở 25oC là 1,8x10-5. Tính pH của dung dịch CH3COOH 0,5M ở 25oC.
-

(1,5đ)
Cho dung dịch HNO3 loãng lần lượt tác dụng với: Al(OH)3; kim loại Zn (N2O là sản phẩm khử duy nhất).
Viết các phương trình hoá học dưới dạng phân tử và ion thu gọn. Nêu vai trò của HNO3 trong mỗi phản ứng.
-

(1đ)
Nhiệt phân hoàn toàn hỗn hợp X gồm KNO3 và Cu(NO3)2 thu được hỗn hợp khí Y có tỉ khối so với oxi là 1,25. Tính % khối lượng của KNO3 trong hỗn hợp X?
-

(4 điểm): Hoàn thành phương trình phân tử, viết phương trình ion thu gọn:
a. KOH + HCl
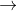
b. Ba(NO3)2 + Na2SO4
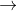
c. CuO + HNO3
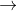
d. (NH4)2CO3 + NaOH
-

(2 điểm)
1. Khi đốt cháy hoàn toàn 1 mol một ankan A thu được số mol CO2 nhỏ hơn 6, còn khi cho A tác dụng Cl2 theo tỉ lệ mol 1:1, có chiếu sáng, chỉ thu được một dẫn xuất monoclo duy nhất. Viết công thức cấu tạo thu gọn của A và các dẫn xuất monoclo tương ứng.
2. Khi trùng hợp buta-1,3-dien với xúc tác natri kim loại ngoài cao su buna còn có một loại polime có nhánh X và một sản phẩm phụ Y.
Viết phương trình phản ứng tạo thành X; Y. Biết rằng khi hidro hóa Y ta thu được etylxiclohexan
-

(1đ)
Cho Kb của CH3COO- ở 25oC là 5,56x10-10. Tính pH của dung dịch CH3COONa 0,5M ở 25oC.
-

(1đ)
Nhiệt phân hoàn toàn hỗn hợp X gồm KNO3 và Cu(NO3)2 thu được hỗn hợp khí Y có tỉ khối so với oxi là d.
Tìm khoảng giá trị của d. Khi d = 1,3 thì % khối lượng của KNO3 trong hỗn hợp X là bao nhiêu?
